L’atomo è costituito da particelle subatomiche chiamate PROTONI, NEUTRONI ed ELETTRONI.
- I protoni sono particelle subatomiche cariche positivamente;
- I neutroni sono particelle subatomiche senza carica elettrica;
- Gli elettroni sono particelle subatomiche cariche negativamente.
Come mostrato nella Figura 1 sottostante, un atomo è composto da un nucleo interno con protoni e neutroni, chiamati per questo anche nucleoni, con gli elettroni collocati esternamente.
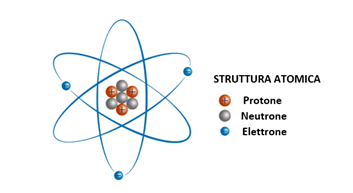
Figura 1 – Rappresentazione della struttura atomica
Tutta la carica positiva è concentrata al centro dell’atomo mentre le cariche negative sono distribuite esternamente. Il ruolo dei neutroni (neutri elettricamente) è quello di aumentare la distanza tra i protoni ed evitare che le forze di repulsione protone-protone destabilizzino la struttura dell’atomo.
La massa delle particelle subatomiche risulta essere estremamente piccola:
- Massa del protone: 1,673×10−27 kg
- Massa del neutrone: 1,675×10−27 kg
- Massa dell’elettrone: 9,109×10−31 kg
I valori elencati indicano la trascuratezza della massa dell’elettrone confrontata a quella del protone e del neutrone. Da un calcolo più dettagliato risulta che la massa dell’elettrone è circa 2000 inferiore rispetto a quella delle altre due particelle subatomiche.
Anche la carica di una particella subatomica assume valori di ridotta entità:
- Carica del protone: + 1,602×10−19 C
- Carica del neutrone: 0 C
- Carica dell’elettrone: – 1,602×10−19 C
La carica di un singolo protone è uguale a quella di un elettrone sebbene con valore opposto. Nella suo insieme, l’atomo è elettricamente NEUTRO. La carica positiva dei protoni nel nucleo viene neutralizzata dalla carica negativa degli elettroni fuori dal nucleo.
Se teniamo in considerazione che la carica di un protone uguaglia quella di un elettrone, si può facilmente dedurre che:
IN UN ATOMO IL NUMERO DI PROTONI UGUAGLIA ESATTAMENTE IL NUMERO DI ELETTRONI
Numero Atomico e Numero di Massa
Gli atomi vengono identificati attraverso due numeri:
- IL NUMERO ATOMICO (Z) che indica il numero di protoni presenti;
- IL NUMERO DI MASSA (A) che indica la somma di protoni e neutroni.
La differenza tra NUMERO DI MASSA e NUMERO ATOMICO (A-Z) dà come risultato il numero di neutroni.
In Figura 2, in una rappresentazione schematica di un elemento chimico, il NUMERO ATOMICO (Z) è riportato in basso a sinistra mentre il NUMERO DI MASSA (A) è riportato in alto a sinistra.
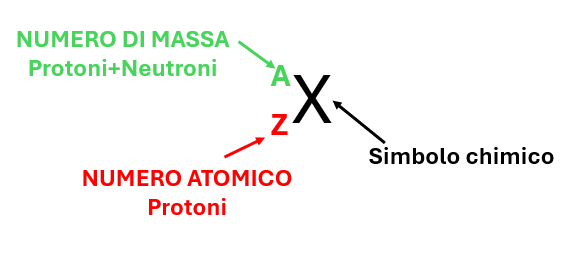
Figura 2 – Rappresentazione schematica del NUMERO ATOMICO (Z) e NUMERO DI MASSA (A)
Concetti chiave:
- Il NUMERO DI MASSA (protoni + neutroni) è sempre riportato in alto a sinistra;
- Il NUMERO ATOMICO (protoni) è sempre riportato in basso a sinistra;
- In un atomo il numero di elettroni uguaglia il numero di protoni;
- Per ottenere il numero di neutroni è sufficiente calcolare la differenza tra NUMERO DI MASSA e NUMERO ATOMICO.
ESERCIZIO SVOLTO:
Determinare il numero di protoni, neutroni ed elettroni del seguente atomo:
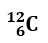
- Il numero atomico rappresenta il numero di protoni ed è riportato in basso a sinistra. p+= 6
- Il numero di elettroni è uguale al numero di protoni. e–= 6
- (Numero di massa – Numero atomico)= Numero di neutroni. n = 12-6 = 6
RISULTATO:
p+= 6;
n = 6;
e–= 6

2 pensieri riguardo “LA STRUTTURA ATOMICA”