Due elementi chimici, con lo stesso numero atomico (Z), ma un differente numero di massa (A), prendono il nome di ISOTOPI.
Vediamo un esempio:
→ Chiamato anche Carbonio-12, è costituito da 6 protoni, 6 neutroni, 6 elettroni;
→ Chiamato anche Carbonio-13, è costituito da 6 protoni, 7 neutroni, 6 elettroni;
→ Chiamato anche Carbonio-14, è costituito da 6 protoni, 8 neutroni, 6 elettroni.
Le tre specie nucleari hanno lo stesso numero di protoni e di elettroni, ma differiscono per il numero di neutroni.
Due elementi chimici, con lo stesso numero atomico (Z), ma un differente numero di massa (A), prendono il nome di ISOTOPI. Gli isotopi hanno lo stesso numero di protoni ed elettroni ma differiscono per il numero di neutroni.
Ciascun elemento della Tavola Periodica è presente sotto forma di diversi isotopi. Il Carbonio è presente come miscela di Carbonio-12, Carbonio-13 e Carbonio-14.
L’isotopo-12 è si trova in una percentuale pari al 98,89%, l’isotopo-13 in percentuale pari all’1,11% mentre l’isotopo-14 è presente solo in piccolissime tracce.
Se fossimo bravi a isolare 1000 atomi di carbonio scopriremmo che 988 sono Carbonio-12, 11 sono Carbonio-13 e, se fossimo molto fortunati, troveremmo un solo Carbonio-14.
I tre isotopi dell’Idrogeno prendono il nome di Prozio (1H), Deuterio (2H), Trizio (3H). Il Prozio rappresenta l’isotopo più abbondante (99,985%), il Deuterio è presente allo 0,015% e si trova nella cosiddetta acqua pesante. Il Trizio è presente in natura in quantità trascurabili.
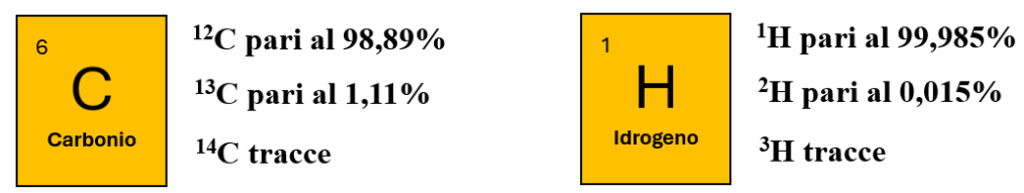
Figura 1 – Miscela di isotopi che costituiscono gli elementi chimici carbonio e idrogeno
CONCETTI CHIAVE:
- Due elementi chimici con lo stesso numero atomico ma diversi numeri di massa si definiscono ISOTOPI.
- Due isotopi differiscono per il numero di neutroni.
- Un elemento della tavola periodica è costituito da diversi isotopi che hanno differente abbondanza in natura.
ESERCIZIO SVOLTO:
Dati i seguenti numeri atomici e numeri di massa Z=8 e A=16, quale elemento tra quelli sottoelencati può considerarsi isotopo?
a) Un elemento neutro con 10 elettroni e 10 neutroni;
b) Un elemento neutro con 10 neutroni e 9 protoni;
c) Un elemento neutro con 10 neutroni e 8 elettroni;
d) Un elemento con 8 elettroni e 9 protoni;
Prendiamo in considerazione ciascuna delle opzioni:
a) L’elemento è elettricamente neutro. Questo implica che il numero di elettroni coincida con il numero di protoni. Pertanto, l’elemento è costituito da 10 protoni, 10 neutroni e 10 elettroni. Z=10, pertanto non è questo l’isotopo ricercato.
b) Il numero di protoni è uguale a 9. Z=9 pertanto, non è questo l’isotopo ricercato.
c) L’elemento è elettricamente neutro. Questo implica che il numero di elettroni coincida con il numero di protoni. Pertanto, l’elemento è costituito da 8 protoni, 10 neutroni e 8 elettroni. Z=8 pertanto questo è l’isotopo ricercato.
d) L’elemento chimico ha un numero di elettroni inferiore di un’unità rispetto al numero di protoni. Pertanto, si tratterà di un catione con una singola carica positiva. Il numero di protoni è tuttavia differente rispetto all’elemento in esame. Dalle informazioni presenti nel punto d non è possibile ricavare il numero di neutroni.

Un pensiero riguardo “ISOTOPI”