La configurazione elettronica di un atomo esprime il modo con cui i suoi elettroni si distribuiscono negli orbitali atomici.
Nel diagramma energetico riportato in Figura 1, gli orbitali atomici sono elencati in ordine di energia crescente. Il riempimento avviene in accordo con il principio di Aufbau, partendo dagli orbitali a più bassa energia e progressivamente salendo verso quelli a più alta energia. L’ordine di riempimento è il seguente:
1s; 2s; 2p; 3s; 3p; 4s; 3d; 4p; 5s; 4d; 5p; 6s; 4f; 5d; 6p; 7s; 5f; 6d; 7p.

Figura 1 – Diagramma d’energia degli orbitali atomici
Il primo periodo della Tavola Periodica: H, He
Il primo elemento della Tavola Periodica è l’Idrogeno che possiede un solo elettrone. Questo andrà a occupare l’orbitale a più bassa energia, ovvero l’orbitale 1s. Nel disegnare questa configurazione elettronica si utilizza la rappresentazione riportata in Figura 2, in cui l’orbitale viene raffigurato con un cerchio o un quadrato, e l’elettrone al suo interno con una freccia. Questo modo di disegnare la configurazione elettronica viene talvolta descritto con il termine di configurazione elettronica casellare.
Quando l’elettrone ha numero quantico di spin +1/2 la freccia è rivolta verso l’alto, quando invece è uguale -1/2 è rivolta verso il basso.
Figura 2 – Rappresentazione schematica della configurazione dell’atomo di idrogeno
La configurazione elettronica può essere scritta per esteso seguendo delle specifiche notazioni. Si scrive in maniera estesa l’elenco degli orbitali riempiti in ordine di energia crescente, e porre come apice il numero di elettroni presenti (Figura 3).
Nel caso dell’idrogeno la configurazione elettronica è 1s1. Questo secondo modo di scrivere la configurazione elettronica viene definito configurazione elettronica lineare.
Figura 3 – Notazione utilizzata per scrivere la configurazione elettronica di un atomo
Il secondo elemento della Tavola Periodica è l’Elio che possiede due elettroni. Questi vanno a occupare l’orbitale a più bassa energia che è ancora l’orbitale 1s. In accordo con il Principio di esclusione di Pauli, l’addizione del secondo elettrone va a completare il riempimento dell’orbitale.
Il secondo elettrone ha numero quantico di spin uguale -1/2 ed è rappresentato con una freccia rivolta verso il basso (Figura 4). La sua configurazione elettronica è 1s2. Con l’elemento Elio si conclude il primo periodo della Tavola Periodica.
Figura 4 – Rappresentazione schematica della configurazione dell’atomo di elio
Il secondo periodo: Li, Be, B, C, N, O, F, Ne
Il terzo elemento della Tavola Periodica è il Litio che possiede tre elettroni. Con esso si entra nel secondo periodo. Seguendo il Principio di Aufbau, i primi due occupano l’orbitale 1s mentre il terzo occupa l’orbitale 2s. La configurazione elettronica lineare può essere scritta come 1s22s1.
Se si esamina con attenzione la struttura atomica di questo elemento, si denota come due elettroni appartengano a un guscio più interno (n=1), avente minore energia, mentre il terzo elettrone appartiene al livello più esterno (n=2) a maggiore energia. I primi due elettroni prendono il nome di elettroni di core, mentre il terzo elettrone di valenza.
Gli elettroni di valenza, appartenenti all’ultimo livello energetico, hanno un ruolo fondamentale, essendo protagonisti delle reazioni chimiche e dei legami che l’atomo può formare. È possibile scrivere una configurazione elettronica esterna o di valenza riportando solo questi elettroni. Nel caso specifico dell’elemento Litio, la prima parte della configurazione elettronica (quella che descrive gli elettroni del core ovvero 1s2) coincide con quella dell’Elio mentre il terzo elettrone di valenza è nell’orbitale 2s. Alla luce di tali considerazioni la configurazione di valenza può essere scritta [He]2s1.
Il quarto elemento della Tavola Periodica è il Berillio che possiede quattro elettroni. I primi due occupano l’orbitale 1s mentre gli altri due l’orbitale 2s. La configurazione elettronica lineare può essere scritta come 1s22s2 o [He]2s2
Il quinto elemento della Tavola Periodica è il Boro che possiede cinque elettroni. Due di questi sono elettroni del core mentre gli altri tre sono elettroni di valenza. La sua configurazione elettronica è 1s22s22p1 o [He]2s22p1
Il sesto elemento della Tavola Periodica è il Carbonio che possiede sei elettroni. Due di questi sono elettroni del core mentre gli altri quattro sono elettroni di valenza. La configurazione elettronica lineare può essere scritta come 1s22s22p2 o [He]2s22p2. Nel valutare la disposizione degli elettroni di valenza nel sottolivello 2p vi sono due possibilità (una corretta e l’altra errata) riportate in Figura 5.
Figura 5 – Le due possibili distribuzioni degli elettroni negli orbitali 2p per il Carbonio
La prima configurazione, con i due elettroni distribuiti in due differenti orbitali nel sottolivello 2p, risulta essere corretta. La regola di Hund detta anche principio della massima molteplicità afferma che nel riempire una serie di orbitali degeneri, gli elettroni si dispongono in modo tale da riempire il maggior numero di orbitali. La prima configurazione, con i due elettroni p occupanti due diversi orbitali con spin uguale o parallelo, è quella a più bassa energia. La seconda configurazione, con gli elettroni distribuiti nello stesso orbitale, risulta meno stabile a causa delle forze di natura repulsiva tra i due elettroni nel medesimo orbitale.
Il settimo elemento della Tavola Periodica è l’Azoto che possiede sette elettroni. Due di questi sono elettroni del core mentre gli altri cinque sono elettroni di valenza. La configurazione elettronica può essere scritta come 1s22s22p3 o [He]2s22p3. Il riempimento avviene seguendo la regola di Hund con il sottolivello 2p semipieno (Figura 6).
Figura 6 – Riempimento degli orbitali di valenza per l’elemento Azoto.
Il secondo periodo della Tavola Periodica si completa con gli elementi Ossigeno, Fluoro, Neon aventi rispettivamente le seguenti configurazioni:

Il terzo periodo: Na, Mg, Al, Si, P, S, Cl, Ar
Il terzo periodo si apre con l’elemento Sodio (Na) avente la seguente configurazione elettronica:
Na: 1s22s22p63s1 o [Ne]3s1
In questo caso tutti gli elettroni del primo e secondo livello (n=1 e n=2) sono considerati elettroni di core, mentre quelli del terzo livello sono elettroni di valenza.
Il riempimento del terzo livello energetico prosegue con gli elementi Magnesio, Alluminio, Silicio, Fosforo, Zolfo, Cloro, Argon aventi rispettivamente le seguenti configurazioni di valenza:
Mg: [Ne]3s2
Al: [Ne]3s23p1
Si: [Ne]3s23p2
P: [Ne]3s23p3
S: [Ne]3s23p4
Cl: [Ne]3s23p5
Ar: [Ne]3s23p6
Il quarto periodo: il guscio 3d
Riprendendo il diagramma già mostrato in Figura 1, si osserva come l’energia dell’orbitale 4s sia inferiore rispetto a quella degli orbitali 3d. In accordo con il principio dell’Aufbau il riempimento dell’orbitale 4s avviene prima di quello degli orbitali 3d.

Figura 7 – Diagramma d’energia degli orbitali atomici
Il quarto periodo della Tavola Periodica si apre con gli elementi Potassio e Calcio (19esimo e 20esimo elemento) aventi rispettivamente le seguenti configurazioni elettroniche:
K: 1s22s22p63s23p64s1 o [Ar]4s1
Ca: 1s22s22p63s23p64s2 o [Ar]4s2
Con il successivo elemento inizia il riempimento degli orbitali 3d.

Analogamente a quanto visto in precedenza, il riempimento degli orbitali 3d avviene rispettando la regola di Hund o il principio della massima molteplicità.
Le configurazioni elettroniche degli elementi Cromo (Cr) e Rame (Cu) sembrano avere qualcosa di anomalo. Nella realtà, ciò che avviene, è una promozione di un elettrone dall’orbitale 4s all’orbitale 3d che permette al Cromo di avere un semi-riempimento completo del guscio 3d, e al Rame un riempimento completo, aspetto che conferisce ai due elementi una maggiore stabilità.
Il quarto periodo si conclude con il riempimento del guscio 4p con gli elementi Gallio (Ga), Germanio (Ge), Arsenico (As), Selenio (Se), Bromo (Br), Kripton (Kr).
Ga: 1s22s22p63s23p64s23d104p1 o [Ar]4s23d104p1
Ge: 1s22s22p63s23p64s23d104p2 o [Ar]4s23d104p2
As: 1s22s22p63s23p64s23d104p3 o [Ar]4s23d104p3
Se: 1s22s22p63s23p64s23d104p4 o [Ar]4s23d104p4
Br: 1s22s22p63s23p64s23d104p5 o [Ar]4s23d104p5
Kr: 1s22s22p63s23p64s23d104p6 o [Ar]4s23d104p6
Il quinto periodo: dal Rubidio allo Xenon
L’andamento del quinto periodo risulta essere quasi speculare a quello già visto per il quarto periodo.
Il riempimento degli orbitali 4d non segue tuttavia un andamento così regolare come invece era stato illustrato per il quarto periodo. Nel caso dell’elemento Palladio, la grande stabilità ottenuta dal riempimento completo del guscio 4d, fa sì che vi sia una promozione dei due elettroni dall’orbitale 5s.
Rb: 1s22s22p63s23p64s23d104p65s1 o [Kr]5s1
Sr: 1s22s22p63s23p64s23d104p65s2 o [Kr]5s2
Y: 1s22s22p63s23p64s23d104p65s24d1 o [Kr]5s24d1
Zr: 1s22s22p63s23p64s23d104p65s24d2 o [Kr]5s24d2
Nb: 1s22s22p63s23p64s23d104p65s14d4o [Kr]5s14d4
Mo: 1s22s22p63s23p64s23d104p65s14d5 o [Kr]5s14d5
Tc: 1s22s22p63s23p64s23d104p65s14d6 o [Kr]5s14d6
Ru: 1s22s22p63s23p64s23d104p65s14d7 o [Kr]5s14d7
Rh: 1s22s22p63s23p64s23d104p65s14d8 o [Kr]5s14d8
Pd: 1s22s22p63s23p64s23d104p64d10 o [Kr]4d10
Ag: 1s22s22p63s23p64s23d104p65s14d10 o [Kr]5s14d10
Cd: 1s22s22p63s23p64s23d104p65s24d10 o [Kr]5s24d10
In: 1s22s22p63s23p64s23d104p65s24d105p1 o [Kr]5s24d105p1
Sn: 1s22s22p63s23p64s23d104p65s24d105p2 o [Kr]5s24d105p2
Sb: 1s22s22p63s23p64s23d104p65s24d105p3 o [Kr]5s24d105p3
Te: 1s22s22p63s23p64s23d104p65s24d105p4 o [Kr]5s24d105p4
I: 1s22s22p63s23p64s23d104p65s24d105p5 o [Kr]5s24d105p5
Xe: 1s22s22p63s23p64s23d104p65s24d105p6 o [Kr]5s24d105p6
Analogamente a quanto visto per il quarto periodo, negli elementi Molibdeno e Argento vi è una promozione di un elettrone dall’orbitale 5s all’orbitale 4d che permette al primo di avere un semi-riempimento completo del guscio 4d mentre al secondo un riempimento completo, cosa che conferisce a entrambi una maggiore stabilità. Ulteriori eccezioni si osservano per gli elementi Niobio (Nb), Tecnezio (Tc), Rutenio (Ru) e Rodio (Rh) con un solo elettrone nell’orbitale 5s.
Il sesto periodo: il guscio 4f
Il sesto periodo si apre con gli elementi Cesio, Bario e Lantanio (55°, 56° e 57° elemento della Tavola Periodica) aventi rispettivamente le seguenti configurazioni:
Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1 o [Xe]6s1
Ba: 1s22s22p63s23p64s23d104p65s24d105p66s2 o [Xe]6s2
La: 1s22s22p63s23p64s23d104p65s24d105p66s25d1 o [Xe]6s25d1 *
Dopo il Lantanio inizia il riempimento dei sette orbitali 4f. Gli elementi che possiedono elettroni negli orbitali 4f appartengono alla famiglia dei Lantanoidi (in passato chiamati Lantanidi) il cui nome deriva dal capostipite Lantanio.
Questi elementi, nella Tavola Periodica, sono collocati in fondo (Figura 8). L’ordine di riempimento di questi orbitali è irregolare e non segue le regole descritte in precedenza.

Figura 8 – Raffigurazione dei Lantanoidi e Attinoidi nella Tavola Periodica
Ce: 1s22s22p63s23p64s23d104p65s24d105p66s24f15d1 o [Xe]6s24f15d1 *
Pr: 1s22s22p63s23p64s23d104p65s24d105p66s24f3 o [Xe]6s24f3
Nd: 1s22s22p63s23p64s23d104p65s24d105p66s24f4 o [Xe]6s24f4
Pm: 1s22s22p63s23p64s23d104p65s24d105p66s24f5 o [Xe]6s24f5
Sm: 1s22s22p63s23p64s23d104p65s24d105p66s24f6 o [Xe]6s24f6
Eu: 1s22s22p63s23p64s23d104p65s24d105p66s24f7 o [Xe]6s24f7
Gd: 1s22s22p63s23p64s23d104p65s24d105p66s24f75d1o [Xe] 6s24f75d1 *
Tb: 1s22s22p63s23p64s23d104p65s24d105p66s24f9 o [Xe]6s24f9
Dy: 1s22s22p63s23p64s23d104p65s24d105p66s24f10 o [Xe]6s24f10
Ho: 1s22s22p63s23p64s23d104p65s24d105p66s24f11 o [Xe]6s24f11
Er: 1s22s22p63s23p64s23d104p65s24d105p66s24f12 o [Xe]6s24f12
Tm: 1s22s22p63s23p64s23d104p65s24d105p66s24f13 o [Xe]6s24f13
Yb: 1s22s22p63s23p64s23d104p65s24d105p66s24f14 o [Xe]6s24f14
Lu: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d1 o [Xe] 6s24f145d1
Da notare che per gli elementi Lantanio (La), Cerio (Ce) e Gadolinio (Gd) il riempimento degli orbitali 5d avviene quando ancora il guscio 4f non è completamente riempito. Il principio di Aufbau prevede che il riempimento del guscio 4f debba avvenire prima del 5d.
Completato il riempimento del guscio 4f inizia il riempimento degli orbitali 5d. Anche in questo caso si trovano delle eccezioni come il Platino (Pt) con un solo elettrone nell’orbitale 6s. Nell’elemento Oro (Au) si osserva ancora una volta la promozione di un elettrone dall’orbitale 6s per ottenere un riempimento completo del guscio 5d, mentre per l’elemento Wolframio non si osserva ciò che era stato riscontrato nel Cromo (quarto periodo) e Molibdeno (quinto periodo).
Hf: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d2 o [Xe] 6s24f145d2
Ta: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d3 o [Xe] 6s24f145d3
W: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d4 o [Xe] 6s24f145d4
Re: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d5 o [Xe] 6s24f145d5
Os: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d6 o [Xe] 6s24f145d6
Ir: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d7 o [Xe] 6s24f145d7
Pt: 1s22s22p63s23p64s23d104p65s24d105p66s14f145d9 o [Xe] 6s14f145d9
Au: 1s22s22p63s23p64s23d104p65s24d105p66s14f145d10 o [Xe] 6s14f145d10
Hg: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d10 o [Xe] 6s24f145d10
Il sesto periodo si completa con il riempimento degli orbitali 6p.
Tl: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p1 o [Xe] 6s24f145d106p1
Pb: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2 o [Xe] 6s24f145d106p2
Bi: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p3 o [Xe] 6s24f145d106p3
Po: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p4 o [Xe] 6s24f145d106p4
At: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p5 o [Xe] 6s24f145d106p5
Ra: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p6 o [Xe] 6s24f145d106p6
Concetti chiave:
- Gli orbitali vengono riempiti in accordo con il principio di Aufbau partendo dagli orbitali a più bassa energia e poi salendo verso quelli a più alta energia;
- Il principio di esclusione di Pauli afferma che in un singolo orbitale possono essere presenti al massimo 2 elettroni aventi spin opposto;
- L’ordine di riempimento è il seguente: 1s; 2s; 2p; 3s; 3p; 4s; 3d; 4p; 5s; 4d; 5p; 6s; 4f; 5d; 6p; 7s; 5f; 6d; 7p;
- Nella configurazione elettronica casellare occorre rispettare la regola di Hund o principio della massima molteplicità.
- Tutti gli elettroni appartenenti ai livelli energetici più interni si definiscono elettroni di core. Solo gli elettroni del livello energetico più esterno si definiscono elettroni di valenza.
Esercizio svolto:
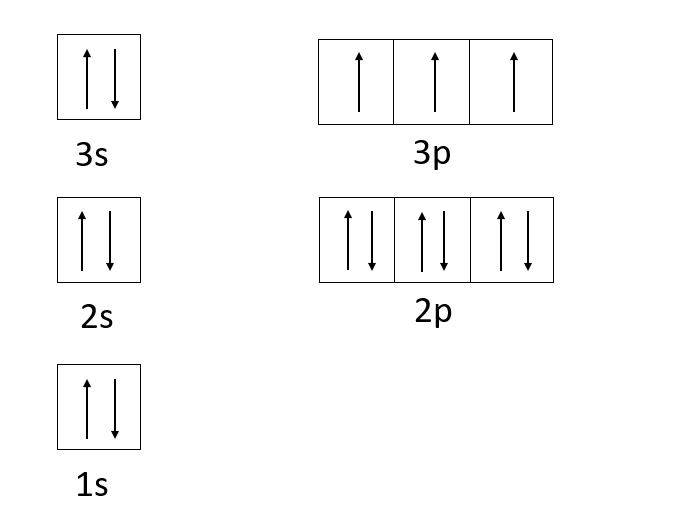
Scrivere la configurazione elettronica lineare e casellare del Fosforo.
Il Fosforo è il 15° elemento della tavola periodica e come elemento neutro possiede 15 protoni e 15 elettroni.
Questi 15 elettroni saranno collocati nei seguenti orbitali:
- 1s (2 elettroni);
- 2s (2 elettroni);
- 2p (6 elettroni);
- 3s (2 elettroni);
- 3p (3 elettroni);
Pertanto la configurazione elettronica lineare può essere scritta come: 1s22s22p63s23p3 o [Ne]3s23p3
Per la configurazione elettronica casellare occorre tenere a mente la regola di Hund per la collocazione dei 3 elettroni negli orbitali 3p.






2 pensieri riguardo “LA CONFIGURAZIONE ELETTRONICA”