Lo stato d’ossidazione o numero d’ossidazione rappresenta la carica formale che acquisisce un elemento quando gli elettroni di legame vengono ceduti all’elemento più elettronegativo.
Nel caso della molecola di acqua, l’Ossigeno forma due legami con altrettanti atomi d’Idrogeno. Ciascun legame è costituito da due elettroni, uno messo in co-partecipazione dall’Idrogeno e l’altro dall’Ossigeno.
Come illustrato in Figura 1, si assuma che l’elettrone di legame dell’idrogeno venga ceduto all’atomo di Ossigeno. L’idrogeno, cedendo il proprio elettrone, acquisisce una carica formale +1, mentre l’Ossigeno, acquistando due elettroni dai due Idrogeni, assume una carica formale di – 2.
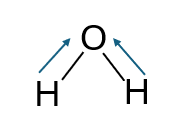
Figura 1 – Molecola d’acqua con trasferimento degli elettroni di legame dagli Idrogeni all’Ossigeno
Gli stati d’ossidazione degli elementi della Tavola Periodica.
Alcuni elementi della Tavola Periodica possono assumere solo uno stato d’ossidazione, mentre altri elementi più stati d’ossidazione.
- Gli elementi del Gruppo IA (metalli alcalini) assumono stato d’ossidazione +1.
- Gli elementi del Gruppo IIA (metalli alcalino terrosi) assumono stato d’ossidazione +2.
- Gli elementi del Gruppo IIIA hanno come stato d’ossidazione più comune (sebbene non l’unico) +3.
- L’Idrogeno ha stato d’ossidazione +1 ad eccezione di quando forma legami con i metalli in cui ha stato d’ossidazione -1.
- L’Ossigeno ha come stato d’ossidazione più comune -2. Può tuttavia in rari casi avere stato d’ossidazione di -1; +1; +2.
- Gli atomi delle molecole omonucleari (formate dagli stessi atomi) hanno stato d’ossidazione uguale a zero. Esempi sono H2, N2, O2, F2, Cl2, Br2, S8.
- I metalli nelle forme elementari hanno stato d’ossidazione zero. Esempio sono Na, Fe, K, Mn, Co, Ni, Cu, ecc.
- Gli ioni monoatomici hanno stato di ossidazione uguale alla carica dello ione. Esempi sono il Fe3+ che ha stato di ossidazione +3 o il Cu2+ che ha stato d’ossidazione +2.
Non occorre tuttavia imparare a memoria gli stati d’ossidazione di tutti gli elementi in quanto nella Tavola Periodica sono riportati i numeri d’ossidazione associati a ogni elemento (Figura 2).
Figura 2 – Numeri d’ossidazione rappresentati nella Tavola Periodica
Calcolo dello stato d’ossidazione per composti neutri
La carica complessiva di un composto elettricamente neutro è pari a zero. Questo significa che nel composto, la carica negativa degli elementi aventi numero d’ossidazione negativo viene annullata dalla carica positiva degli elementi aventi numero d’ossidazione positivo.
HNO3 è un composto che nel suo complesso è neutro.
- L’Idrogeno ha numero d’ossidazione pari a +1.
- L’Ossigeno ha numero d’ossidazione pari a -2. Tuttavia essendoci tre atomi di Ossigeno il numero d’ossidazione complessivo degli Ossigeni è -6.
- Affinché la molecola risulti neutra, il numero di ossidazione dell’atomo di Azoto deve essere uguale a +5.
Carica complessiva: +1 + 5 + 3 x (-2) = 0
Calcolo dello stato d’ossidazione per gli ioni poliatomici.
Nel caso di ioni poliatomici occorre tenere in considerazione il fatto che il composto non è elettricamente neutro ma assume una carica che può essere positiva o negativa.
SO42- è un anione che nel suo complesso ha carica -2.
- L’Ossigeno ha numero d’ossidazione pari a -2. Tuttavia essendoci quattro atomi di Ossigeno, il numero d’ossidazione complessivo degli Ossigeni è -8.
- Per avere nel complesso una carica di -2 è necessario che lo Zolfo (S) abbia una carica di +6.
Carica complessiva: +6 + 4 x (-2) = -2
CONCETTI CHIAVE:
- All’interno di un composto vi sono elementi che hanno numero d’ossidazione positivo e altri numero d’ossidazione negativo;
- L’elemento più elettronegativo del composto ha numero d’ossidazione negativo;
- La somma degli stati d’ossidazione di tutti gli elementi devono dare come risultato la carica complessiva del composto.
Esercizio svolto:
Determinare lo stato d’ossidazione di tutti gli elementi che compongono lo ione poliatomico NH4+:
- La carica complessiva del composto è +1;
- Sono presenti 4 atomi di idrogeno ciascuno avente numero d’ossidazione +1. Pertanto, nel complesso il numero d’ossidazione dei quattro Idrogeni è uguale a +4;
- Affinché il complesso abbia carica complessiva +1, l’Azoto deve avere numero d’ossidazione -3;
- Carica complessiva: 1 x (-3) + 4 x (+1) = +1
Approfondimenti:
Esercizio al seguente link sul calcolo del numero di ossidazione.
