L’equilibrio chimico è una condizione che viene raggiunta quando la velocità della reazione diretta eguaglia la velocità della reazione inversa.
Reazione diretta e reazione inversa
Si consideri la seguente reazione:
aA + bB ⇄ rR + sS
A, B, R, S sono le specie chimiche che partecipano alla reazione.
a, b, r, s sono i coefficienti stechiometrici della reazione.
Al tempo zero (t0) nel sistema di reazione sono presenti solo le specie A e B. Al procedere della reazione, i reagenti vengono convertiti in prodotti e il numero di molecole A e B diminuisce, mentre il numero di molecole R e S aumenta (Figura 1).

Figura 1 – Conversione dei reagenti in prodotti al variare del tempo
All’aumentare della concentrazione dei prodotti, prende forma la reazione inversa, ovvero la conversione dei prodotti R e S nei reagenti A e B.
Condizione di equilibrio chimico
La velocità della reazione diretta è massima a t0 quando nel sistema sono presenti solo i reagenti A e B, e diminuisce progressivamente al calare della loro concentrazione.
La velocità della reazione inversa è nulla a t0 quando non sono presenti i prodotti R e S e aumenta nel tempo al crescere della loro concentrazione.
Come illustrato in Figura 2, si arriva a una condizione di equilibrio quando la velocità con cui A e B si convertono in R e S (reazione diretta) eguaglia la velocità con cui R e S si trasformano in A e B (reazione inversa).
Nell’unità di tempo, il numero di molecole di reagenti che si convertono in prodotti è uguale a quelle di prodotti che si convertono in reagenti.
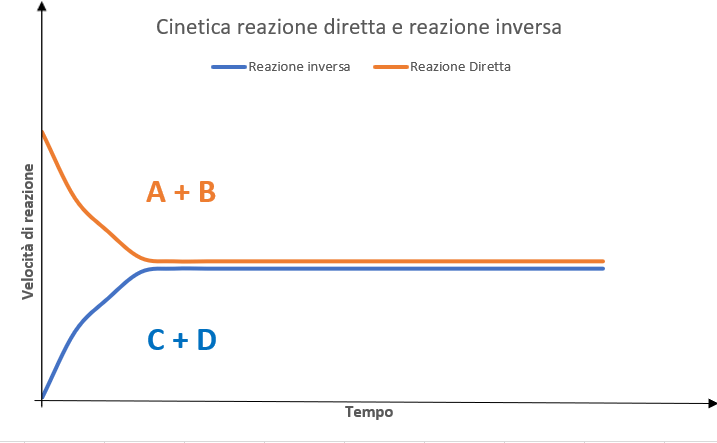
Figura 2 – Andamento della velocità diretta e inversa di reazione al variare del tempo
Una volta raggiunta la condizione di equilibrio, la concentrazione dei reagenti e dei prodotti rimane costante nel tempo (Figura 3).
A livello macroscopico il sistema non subisce variazioni e agli occhi di un osservatore esterno può sembrare che la reazione si sia arrestata. Nella realtà, le reazioni dirette e inverse avvengono, ma non si osservano variazioni fisiche in virtù della medesima velocità con cui queste procedono.
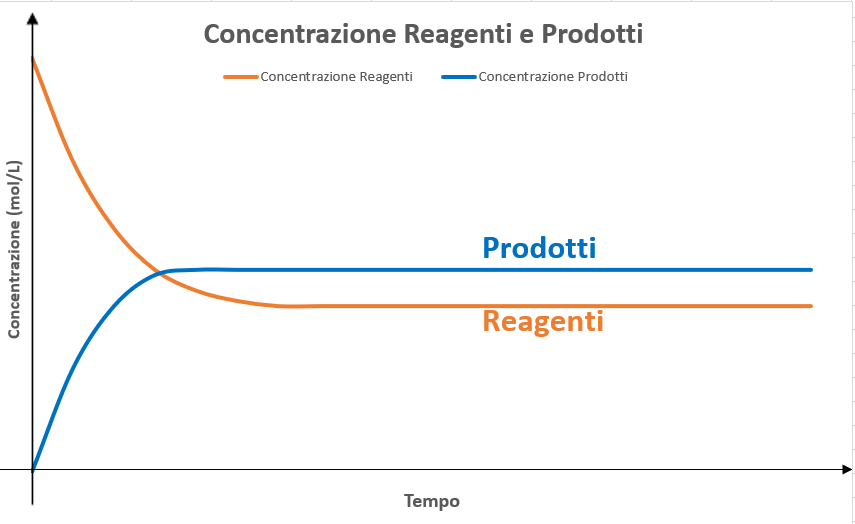
Figura 3 – Andamento della concentrazione dei reagenti e prodotti al variare del tempo
PRESTARE ATTENZIONE:
Il raggiungimento dell’equilibrio chimico non implica necessariamente che le concentrazioni di reagenti e prodotti siano tra loro uguali. Alcune reazioni hanno un equilibrio fortemente spostato verso i reagenti e al raggiungimento dell’equilibrio, nel sistema sono presenti molte più molecole di reagenti rispetto a quelle dei prodotti. Altre reazioni hanno invece un equilibrio più spostato verso i prodotti e all’equilibrio, sono presenti molte più molecole di prodotto rispetto a quelle di reagente.
Reazioni reversibili e reazioni quantitative
Si prenda la reazione:
aA + bB ⇄ cC + dD
La reazione è stata scritta con la doppia freccia. Questa simbologia viene utilizzata per reazioni che raggiungono l’equilibrio anche dette REAZIONI REVERSIBILI.
Non tutte le reazioni sono però in grado di raggiungere un equilibrio. In alcuni casi, al termine della reazione, vi è un consumo completo dei reagenti. Queste tipologie di reazione si definiscono A COMPLETAMENTO o QUANTITATIVE e si scrivono con il simbolo della singola freccia.
aA + bB → cC + dD
CONCETTI CHIAVE:
- La condizione d’equilibrio chimico viene raggiunta quando le velocità della reazione diretta e inversa sono tra loro uguali.
- Una volta raggiunto l’equilibrio, le concentrazioni dei reagenti e dei prodotti rimangono inalterate.
- Le reazioni all’equilibrio vengono scritte con il simbolo della doppia freccia.
- Le reazioni quantitative vengono scritte solo con una freccia.
