TEORIA DI ARRHENIUS
Il primo teorico sul comportamento degli acidi e delle basi fu il chimico svedese Svante August Arrhenius. Secondo la teoria di Arrhenius un acido era una specie chimica che posta in acqua era in grado di aumentare la concentrazione di ioni idrogeno (H+) mentre una base era una specie chimica che una volta posta in acqua era in grado di aumentare la concentrazione di ioni idrossido (OH–).
In accordo con questa teoria, Acido Cloridrico (HCl), Acido Nitrico (HNO3), Acido Acetico (CH3COOH) sono acidi in quanto, dopo essere stati disciolti in acqua, liberano ioni H+.
Idrossido di Sodio (NaOH), Idrossido di Potassio (KOH) sono basi in quanto in grado di liberare in acqua ioni idrossido (OH–).
Questa teoria presentava alcune limitazioni come il fatto di poter essere utilizzata solo per soluzioni acquose e di non riuscire a spiegare il comportamento acido di molecole come CO2 o il comportamento basico dell’Ammoniaca (NH3).
TEORIA DI LOWRY-BRONSTED
Una seconda teoria più generale fu sviluppata dal chimico britannico Thomas Martin Lowry e dal chimico danese Johannes Nicolaus Bronsted secondo cui un acido è una specie chimica in grado di cedere ioni H+, mentre una base era una specie chimica in grado di accettare ioni H+.
Si prenda in considerazione la seguente reazione:
HCl + H2O → Cl– + H3O+
Secondo la teoria di Lowry-Bronsted, HCl è l’acido in quanto donatore di uno ione H+ all’acqua che a sua volta, accettando tale ione, si comporta da base.
Dalla reazione si forma Cl– che può avere un comportamento basico e H3O+ (ione idronio) che a sua volta può avere un comportamento acido. Secondo la teoria di Lowry-Bronsted in ogni reazione acido-base si vengono a creare due coppie acido-base coniugate.

Si prenda in considerazione la seguente reazione:
NH3 + H2O → NH4+ + OH–
Secondo la teoria di Lowry-Bronsted, l’Acqua ha comportamento acido in quanto donatore di uno ione idrogeno all’Ammoniaca (NH3) che a sua volta, accettando tale ione, si comporta da base.
Nella precedente reazione l’Acqua costituiva la base, in questa invece ha un comportamento acido. Sostanze come l’Acqua, in grado di comportarsi sia da acido che da base, si dicono anfotere o anfiprotiche.
TEORIA DI LEWIS
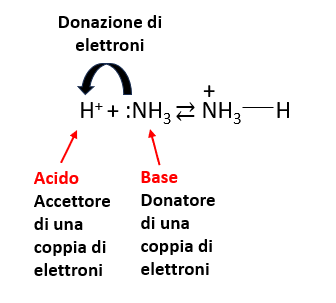
Una terza teoria fu quella sviluppata da Gilbert Newton Lewis secondo cui un acido è un accettore di elettroni mentre una base è un donatore di elettroni.
Secondo questa teoria qualsiasi nucleofilo è una potenziale base e ogni specie elettrofila è un potenziale acido.
Si prenda l’esempio dell’Ammoniaca. Secondo la teoria di Lowry-Bronsted. questa molecola poteva essere inserita nella categoria delle basi in quanto accettore di un protone.
La struttura di NH3 presenta tre orbitali ibridi sp3 impegnati a formare altrettanti legami con tre atomi di Idrogeno, mentre un quarto orbitale sp3 contiene una coppia di elettroni non impegnati nel legame (Figura 1).

Figura 1 – Rappresentazione della struttura dell’Ammoniaca
Questi due elettroni di non legame possono essere donati a uno ione H+ per formare lo ione NH4+.
TEORIE A CONFRONTO
La teoria di Lewis non contrasta con quella di Lowry-Bronsted in quanto specie come HCl, CH3COOH, HNO3 sono donatori di ioni H+ che rappresentano gli accettori di elettroni per eccellenza.
Specie come NH3, H2O, OH– sono accettori di ioni H+ (base di Lowry-Bronsted) e donatori di elettroni tramite i doppietti di non legame di Azoto e Ossigeno (base di Lewis).
Un acido di Lewis è anche un acido di Lowry-Bronsted, una base di Lewis è anche una base di Lowry-Bronsted.
La definizione di acido e base di Lewis rappresenta un estensione alla teoria di Lowry-Bronsted considerando acide anche sostanze come AlCl3, BF3 e BH3 non in grado di donare ioni H+. La struttura di queste molecole (Figura 2) è caratterizzata da tre orbitali ibridi sp2 impegnati in altrettanti legami e un orbitale p vuoto in grado di accettare elettroni.
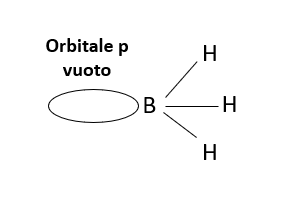
Figura 2 – Rappresentazione della struttura del Borano
CONCETTI CHIAVE:
- Secondo la Teoria di Arrhenius un acido è una sostanza che una volta disciolta in acqua incrementa la concentrazione di ioni H+, mentre una base una sostanza una sostanza in grado di aumentare la concentrazione di ioni OH–.
- Secondo la Teoria di Lowry-Bronsted un acido è un donatore di ioni H+, mentre una base è un accettore di ioni H+.
- Secondo la Teoria di Lewis un acido è un accettore di elettroni, mentre una base è un donatore di elettroni.
- Un acido di Lewis è anche un acido di Lowry-Bronsted, una base di Lewis è anche una base di Lowry-Bronsted.
