Gli atomi vengono identificati attraverso due numeri:
- IL NUMERO ATOMICO (Z) che indica il numero di protoni;
- IL NUMERO DI MASSA (A) che indica la somma di protoni e neutroni.
La differenza tra NUMERO DI MASSA e NUMERO ATOMICO (A-Z) dà come risultato il numero di neutroni.
In Figura 1, in una rappresentazione schematica di un elemento chimico, il NUMERO ATOMICO (Z) è riportato in basso a sinistra, mentre il NUMERO DI MASSA (A) è riportato in alto a sinistra.
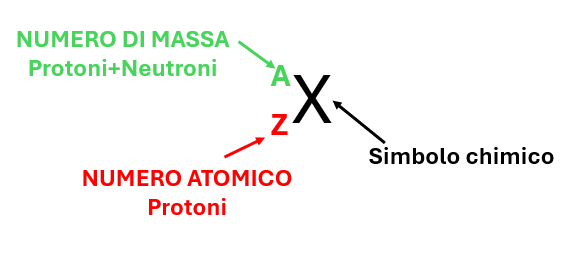
Figura 1 – Rappresentazione schematica del NUMERO ATOMICO (Z) e NUMERO DI MASSA (A)
Il numero atomico identifica in maniera unica un elemento chimico. Come mostrato in Figura 2, la tavola periodica è rappresentata da tante caselle consecutive, ciascuna contenente un elemento chimico raffigurato con una singola lettera (H, B, C, N, O, F, ecc.) o due lettere (Ca, Mg, Na, Li, Be, Hg, ecc.). La prima lettera è sempre riportata con la lettera maiuscola.

Figura 2 – Rappresentazione del numero atomico (Z) nella tavola periodica
Il numero atomico è sempre associato a UNO E UNO SOLO elemento chimico della tavola periodica. Costituisce l’impronta digitale dell’elemento.
All’Idrogeno è associato sempre e solo il Numero Atomico 1, all’Elio 2, al Litio 3, al Berillio 4, al Boro 5 e così via.
CONCETTI CHIAVE:
- Il NUMERO DI MASSA (protoni + neutroni) è sempre riportato in alto a sinistra;
- Il NUMERO ATOMICO (protoni) è sempre riportato in basso a sinistra;
- Per ottenere il numero di neutroni è sufficiente calcolare la differenza tra NUMERO DI MASSA e NUMERO ATOMICO.
- A un elemento chimico è sempre associato un solo NUMERO ATOMICO.
ESERCIZIO SVOLTO:
Determinare il numero di protoni, neutroni ed elettroni del seguente atomo:
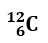
- Il numero atomico rappresenta il numero di protoni ed è riportato in basso a sinistra. p+= 6
- Il numero di elettroni è uguale al numero di protoni. e–= 6
- (Numero di massa – Numero atomico)= Numero di neutroni. n = 12-6 = 6

2 pensieri riguardo “NUMERO ATOMICO E NUMERO DI MASSA”