Le reazioni chimiche sono accompagnate da un assorbimento di calore da parte del sistema o da un rilascio di calore dal sistema verso l’ambiente esterno. A seconda della direzione in cui avviene il flusso di calore, le reazione chimiche possono essere classificate come:
- Endotermiche quando avviene un assorbimento di calore da parte del sistema.
- Esotermiche quando avviene un rilascio di calore da parte del sistema.
REAZIONI ENDOTERMICHE
Quando a seguito di una reazione chimica si assiste a un trasferimento di calore dall’ambiente esterno verso il sistema, l’entalpia di quest’ultimo aumenta.
Reazioni chimiche in cui si assiste a un assorbimento di calore da parte del sistema si definiscono ENDOTERMICHE (Figura 1).
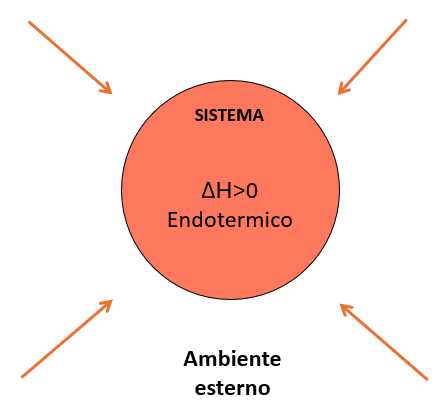
Figura 1 – Schematizzazione di un processo endotermico
Nelle reazioni endotermiche, il calore può essere considerato come parte integrante della reazione stessa. Infatti, senza il contributo del calore proveniente dall’ambiente esterno, la reazione non procederebbe.
Per tale ragione il calore Q può essere considerato come un reagente che prende parte alla reazione.
CH4 + H2O + Q ⇄ CO + 3H2
ΔH = +206 KJ/mol
REAZIONI ESOTERMICHE
Quando a seguito di una reazione chimica il calore viene liberato dal sistema, l’entalpia di questo diminuisce. L’allontanamento di calore dal sistema comporta una diminuzione della sua temperatura.
Reazioni chimiche associate a un rilascio di calore da parte del sistema a favore dell’ambiente esterno si definiscono ESOTERMICHE (Figura 2).

Figura 2 – Schematizzazione di un processo esotermico
Nelle reazioni esotermiche, il calore può essere considerato come un prodotto della reazione stessa.
CO + H2O ⇄ CO2 + H2 + Q
ΔH = -41 KJ/mol
PERCHÉ ALCUNE REAZIONI SONO ENDOTERMICHE E ALTRE ESOTERMICHE?
Quando avviene una reazione chimica si ha una rottura dei legami nelle molecole dei reagenti e la formazione di nuovi legami per la formazione dei prodotti.
- La rottura di legami chimici è un processo che assorbe calore.
- La formazione di legami chimici è un processo che libera calore.
ΔH della reazione = (energia dei legami che si sono rotti) – (energia dei legami che si sono formati)
- Se i legami che si sono formati nei prodotti sono più forti di quelli che si sono rotti nei reagenti ΔH<0 e la reazione è esotermica.
- Se i legami che si sono formati nei prodotti sono più deboli di quelli che si sono rotti nei reagenti ΔH>0 e la reazione è endotermica.
DIAGRAMMI DI ENERGIA
In una reazione endotermica vi è un assorbimento di calore da parte del sistema utile per fare avvenire la reazione. Per il principio di conservazione dell’energia, al termine della reazione i prodotti hanno un’entalpia superiore ai reagenti.
In una reazione esotermica si assiste a un rilascio di calore nel corso della reazione. Pertanto l’entalpia dei prodotti, al termine della reazione, è inferiore rispetto a quella dei reagenti (Figura 3).

Figura 3 – Diagramma energetico per reazioni endotermiche (sinistra) ed esotermiche (destra).
CONCETTI CHIAVE:
- Una reazione endotermica richiede un assorbimento di calore da parte del sistema.
- Una reazione esotermica è accompagnata dal rilascio di calore da parte del sistema.
- In una reazione endotermica i legami nei prodotti sono meno stabili rispetto a quelli dei reagenti.
- In una reazione esotermica i legami nei prodotti sono più stabili rispetto a quelli dei reagenti.

Un pensiero riguardo “REAZIONI ENDOTERMICHE ED ESOTERMICHE”