Il principio di Le Chatelier afferma che se un sistema all’equilibrio è soggetto a una perturbazione, esso reagisce in modo da minimizzare l’effetto di tale perturbazione.
Le perturbazioni a cui un sistema è soggetto sono:
- Aggiunta o allontanamento di un reagente o un prodotto di reazione.
- Variazione del volume o pressione.
- Variazione della temperatura.
Aggiunta o allontanamento di un reagente o un prodotto di reazione
Si prenda in considerazione la reazione utilizzata industrialmente per la produzione di ammoniaca:
N2(g) + 3H2(g) ⇄ 2NH3(g)
Al raggiungimento dell’equilibrio, le concentrazioni di reagenti e prodotti sono tali da rispettare il valore della costante d’equilibrio Kc.
Se dall’esterno viene addizionato azoto gassoso, si ha un aumento delle concentrazioni dei reagenti al denominatore, e il valore della costante d’equilibrio non è più rispettato. Il quoziente di reazione Q diventa minore di Kc. Per rispristinare l’equilibrio, il sistema si oppone alla perturbazione convertendo un’ulteriore aliquota di reagenti in prodotti fino a che le loro concentrazioni sono di nuovo coerenti con il valore di Kc. In questo modo viene favorita la reazione diretta.
L’aumento della concentrazione dei reagenti favorisce la formazione dei prodotti.
Se dall’esterno viene addizionata invece ammoniaca gassosa, si assiste a un aumento della concentrazione dei prodotti al numeratore e il valore del quoziente di reazione Q diventa maggiore di Kc. Per rispristinare l’equilibrio, il sistema si oppone alla perturbazione convertendo un’ulteriore aliquota di prodotti nei reagenti, fino a a che le loro concentrazioni sono di nuovo coerenti con il valore di Kc. In questo modo viene favorita la reazione inversa.
L’aumento della concentrazione dei prodotti favorisce la formazione dei reagenti.
Se l’ammoniaca viene allontanata dal sistema, si ha una quantità di prodotto in difetto che il sistema cerca di ripristinare. Infatti, con la diminuzione della concentrazione al numeratore, il valore alla costante d’equilibrio non è più rispettato e Q<Kc. Il sistema si oppone alla perturbazione favorendo la reazione diretta per convertire un’ulteriore aliquota di reagenti nei prodotti desiderati, fino a che le loro concentrazioni sono di nuovo coerenti con il valore di Kc.
La diminuzione della concentrazione dei prodotti favorisce la formazione dei prodotti.
Se dall’ambiente di reazione andassimo ad allontanare uno dei reagenti, il sistema cercherà di ripristinare l’equilibrio aumentando la concentrazione dei reagenti. L’unico modo è quello di favorire la reazione inversa e aumentare la concentrazione dei reagenti fino a ottenere concentrazioni che siano nuovamente solidali con Kc.
La diminuzione della concentrazione dei reagenti favorisce la formazione dei reagenti.
Variazione del volume o della pressione
Si consideri la seguente reazione all’equilibrio in fase gassosa:
2P2(g) ⇄ P4(g)
La reazione avviene con una diminuzione del numero di moli, con due moli di reagente che vengono convertite in una mole di prodotto.
S’immagini ora di ridurre il volume del sistema (Figura 1). Secondo la legge di Boyle, a una diminuzione del volume corrisponde un aumento della pressione.
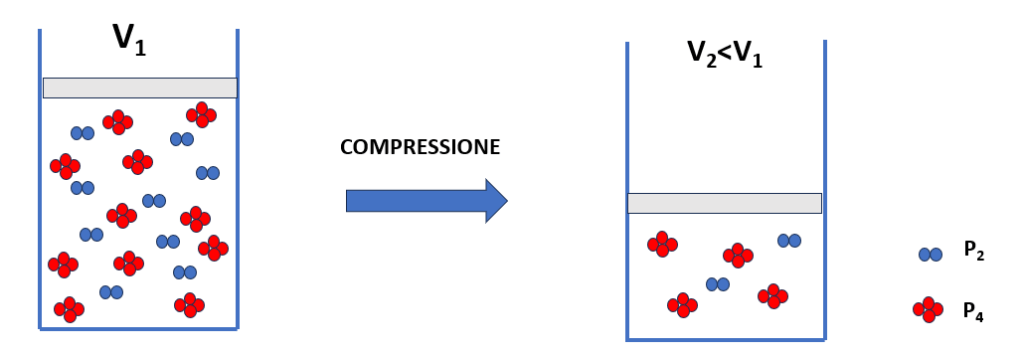
Figura 1 – Contenitori in cui sono presenti molecole di reagente e di prodotto. Nel secondo contenitore il volume è stato ridotto.
Il sistema tende a opporsi a questa perturbazione cercando di ridurre la pressione totale. L’unico modo per raggiungere tale scopo è quello di ridurre il numero di molecole gassose. Dalla stechiometria della reazione, questo è possibile solo favorendo la reazione diretta che porta a una riduzione del numero di moli.
Un aumento della pressione favorisce la reazione che porta a una diminuzione del numero di moli.
Un aumento del volume corrisponde invece a una diminuzione della pressione. In questo caso il sistema reagisce aumentando il numero di molecole gassose in modo da ripristinare la pressione iniziale. Questo è possibile solo favorendo la reazione inversa che porta a un aumento del numero di moli.
Una diminuzione della pressione favorisce la reazione che porta a un aumento del numero di moli.
Per una reazione:
H2(g) + I2(g) ⇄ 2HI(g)
Non si denota una variazione del numero di moli. Per questa tipologia di reazioni, un cambiamento della pressione non ha alcun effetto sull’equilibrio.
Variazione della temperatura
Si consideri la seguente reazione esotermica:
2SO2(g) + O2(g) ⇄ 2SO3(g)
ΔH= -197,8 KJ/mol
Dal momento che la reazione libera energia, questa può essere considerata come un prodotto della reazione stessa. É possibile riscrivere la reazione nel seguente modo:
2SO2(g) + O2(g) ⇄ 2SO3(g) + energia
Se dall’esterno viene innalzata la temperatura, il sistema reagisce in modo da ripristinare la temperatura iniziale. Per raggiungere tale scopo è necessario ridurre la quantità di calore (energia) liberato nel corso della reazione. L’unico modo è quello di favorire la reazione inversa che invece assorbe calore, con un aumento nella concentrazione dei reagenti e diminuzione in quella dei prodotti. (Da ricordare, se la reazione diretta è esotermica quella inversa è endotermica e viceversa).
Il nuovo equilibrio è caratterizzato da un nuovo valore di costante d’equilibrio inferiore rispetto al precedente.
Se invece dall’esterno viene abbassata la temperatura, il sistema reagisce favorendo la reazione diretta che porta a un rilascio di calore. Questo porta un aumento nella concentrazione dei prodotti e una diminuzione in quella dei reagenti.
Il nuovo equilibrio è caratterizzato da un nuovo valore costante di equilibrio maggiore rispetto al precedente.
- Un incremento della temperatura favorisce la reazione nella direzione che produce un assorbimento di calore (variazione endotermica).
- Una diminuzione della temperatura sposta la reazione nella direzione che produce un rilascio di calore (variazione esotermica).
CONCETTI CHIAVE:
- L’aggiunta o l’allontanamento di un reagente o di un prodotto all’equilibrio, porta il sistema a reagire in modo da mantenere le concentrazioni di reagenti e prodotti solidali con il valore di Kc.
- Per reazioni in fase gassosa la variazione della pressione all’equilibrio, porta il sistema a reagire in modo da mantenere le pressioni parziali di reagenti e prodotti solidali con il valore di Kp.
- Una variazione di temperatura all’equilibrio, porta a un nuovo equilibrio, con un nuovo valore di costante d’equilibrio.
- La costante d’equilibrio dipende solo dalla temperatura.
