pH
Il pH si ottiene calcolando l’opposto del logaritmo decimale dalla concentrazione di ioni H+.
pH = -log10 [H+]
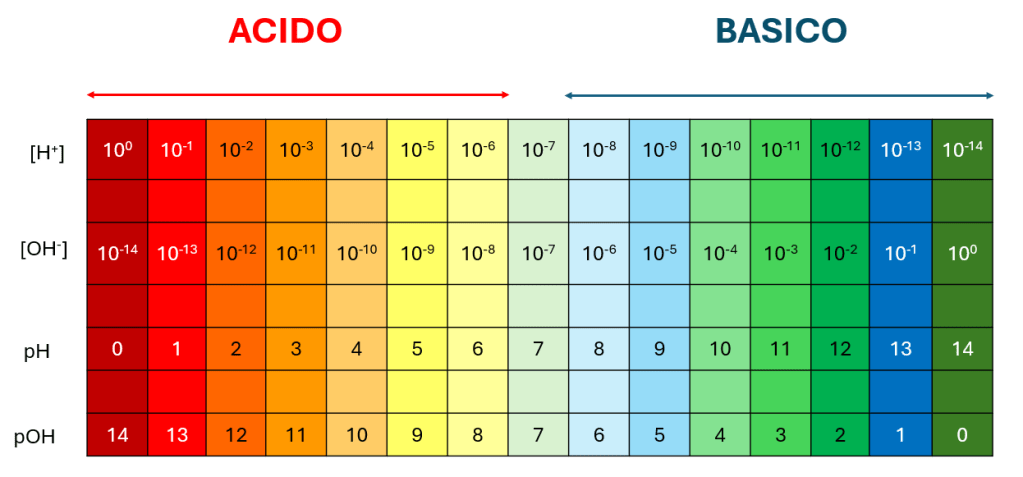
Se la concentrazione degli ioni H+ è uguale a 10-1 M allora il valore di pH risulta pari a 1.
Se la concentrazione degli ioni H+ è uguale a 10-10 M allora il valore di pH risulta pari a 10.
Se la concentrazione degli ioni H+ è uguale a 10-7 M allora il valore di pH risulta pari a 7.
All’aumentare della concentrazione di ioni H+ corrisponde un abbassamento del valore del pH.
Una soluzione può definirsi:
- Acida se pH<7
- Neutra se pH=7
- Basica se pH>7
Il pH viene misurato in una scala che va da 0 a 14 che corrisponde a concentrazioni di ioni H+ che vanno da 1M a 10-14M. Sebbene siano rari, possono esistere valori di pH negativi per soluzioni in cui la concentrazione di ioni H+ è superiore a 1M e valori di pH superiori a 14, per soluzioni in cui la concentrazione di ioni H+ è inferiore a 10-14M.
pOH
Il pOH si ottiene calcolando l’opposto del logaritmo decimale dalla concentrazione di ioni OH–.
pOH = -log10 [OH–]
Se la concentrazione degli ioni OH– è uguale a 10-1 M allora il valore di pOH risulta pari a 1.
Se la concentrazione degli ioni OH– è uguale a 10-10 M allora il valore di pOH risulta pari a 10.
Se la concentrazione degli ioni OH– è uguale a 10-7 M allora il valore di pOH risulta pari a 7.
All’aumentare della concentrazione di ioni OH– corrisponde un abbassamento del valore del pOH.
Una soluzione può definirsi:
- Acida se pOH >7
- Neutra se pOH=7
- Basica se pOH < 7
Il pOH viene misurato in una scala che va da 0 a 14 che corrisponde a concentrazioni di ioni OH– che vanno da 1M a 10-14M. Sebbene siano rari, possono esistere valori di pOH negativi per soluzioni in cui la concentrazione di ioni OH– è superiore a 1M e valori di pOH superiori a 14, per soluzioni in cui la concentrazione di ioni OH– è inferiore a 10-14M.
Relazione tra pH e pOH
Si può individuare una relazione tra pH e pOH secondo cui:
pH + pOH = 14
Se volessimo tradurre questa relazione in termini di concentrazioni si può scrivere:
[H+]·[OH–] = 10-14
CONCETTI CHIAVE
- Il pH misura la concentrazione di ioni H+ in soluzione e può essere calcolato come pH = -log10[H+].
- Il pOH misura la concentrazione di ioni OH– in soluzione e può essere calcolato come pOH = -log10[OH–].
- La relazione tra pH e pOH è pH + pOH = 14.

Un pensiero riguardo “pH e pOH”