L’ibridazione degli orbitali è un’operazione matematica con cui gli orbitali atomici si combinano tra loro per formare orbitali ibridi.
Il numero di orbitali ibridi che si ottengono è uguale al numero di orbitali atomici che vengono combinati. Anche la composizione degli orbitali ibridi rispecchia quella degli orbitali atomici da cui si sono formati.
ORBITALI IBRIDI sp
La combinazione di un orbitale s e un orbitale p porta alla formazione di due orbitali ibridi che prendono il nome di orbitali sp.
Questi due orbitali ibridi avranno le seguenti caratteristiche:
- Hanno un 50% carattere s e un 50% carattere p.
- Si dispongono simmetricamente in un piano formando un angolo di 180°.
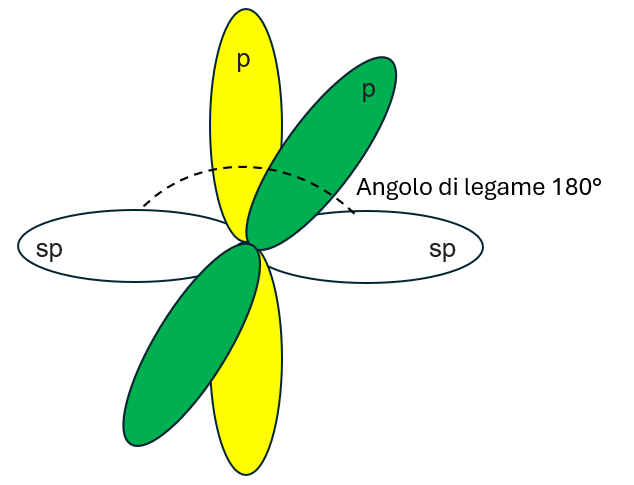
Dal momento che gli orbitali atomici p sono tre, gli altri due esclusi dall’ibridazione si dispongono fuori dal piano perpendicolarmente tra loro e perpendicolari al piano degli orbitali ibridi.
ORBITALI IBRIDI sp2
La combinazione di un orbitale s e due orbitali p porta alla formazione di tre orbitali ibridi che prendono il nome di orbitali sp2.
Questi tre orbitali ibridi avranno le seguenti caratteristiche:
- Hanno un 33,3% carattere s e un 66,6% carattere p.
- Si dispongono ai vertici di un triangolo equilatero formando angoli di 120°.
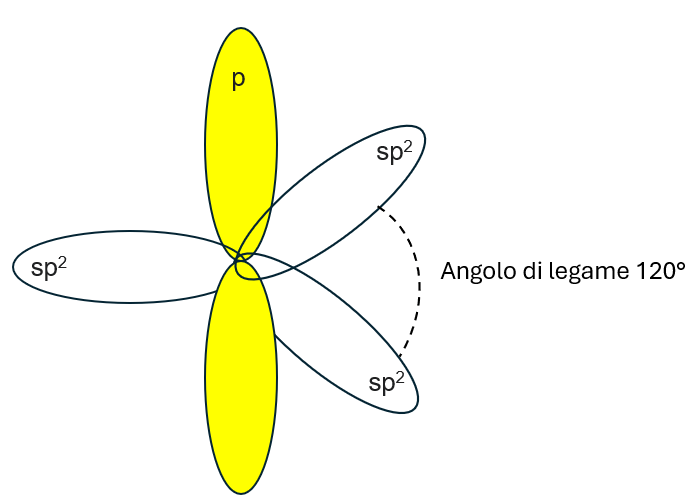
Dal momento che gli orbitali atomici p sono tre, il terzo escluso dall’ibridazione si dispone fuori dal piano perpendicolarmente al piano degli orbitali ibridi.
ORBITALI IBRIDI sp3
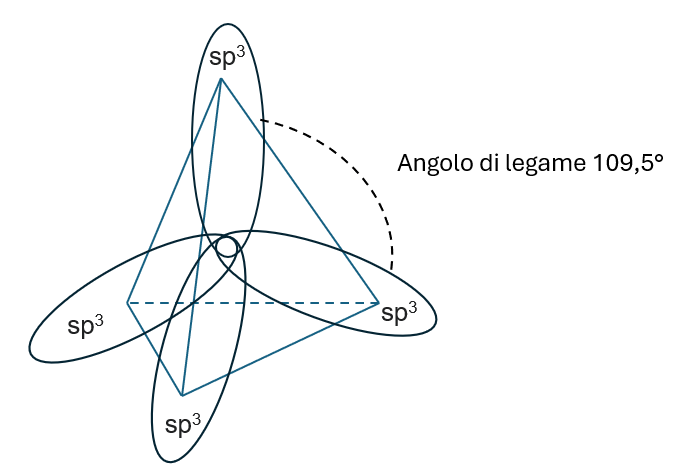
La combinazione di un orbitale s e tre orbitali p porta alla formazione di quattro orbitali ibridi che prendono il nome di orbitali sp3.
Questi tre orbitali ibridi avranno le seguenti caratteristiche:
- Hanno un 25% carattere s e un 75% carattere p.
- Si dispongono ai vertici di un tetraedro formando angoli di circa 109,5°.
CONCETTI CHIAVE:
- Gli orbitali ibridi si ottengono per combinazione di orbitali atomici.
- Il numero di orbitali orbitali ibridi che si ottengono è uguale al numero di orbitali atomici che si combinano.
- La combinazione di un orbitale s e un orbitale p porta alla formazione di due orbitali ibridi sp che formano un angolo di 180°.
- La combinazione di un orbitale s e due orbitali p porta alla formazione di tre orbitali ibridi sp2 che formano un angolo di 120°.
- La combinazione di un orbitale s e tre orbitali p porta alla formazione di quattro orbitali ibridi sp3 che formano un angolo di circa 109,5°
