L’elettronegatività è la tendenza di una specie chimica ad attrarre verso di sé la nuvola elettronica in un legame chimico.
La scala di elettronegatività più utilizzata è quella proposta da Linus Pauling nel 1932, secondo cui, fatta qualche eccezione, questa aumenta dal basso all’alto in un gruppo, e da sinistra a destra in un periodo (Figura 1).
Da questo andamento devono essere esclusi i gas nobili (elementi del gruppo Gruppo VIIIA).
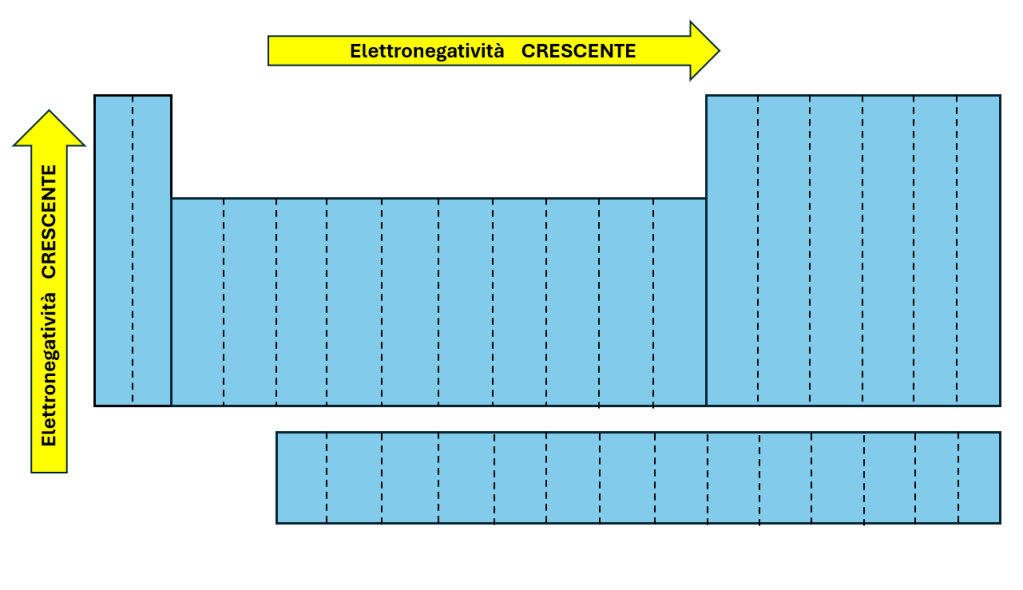
Figura 1 – Andamento dell’elettronegatività nella tavola periodica
ELETTRONEGATIVITÁ E LEGAMI CHIMICI
La differenza di elettronegatività può essere impiegata per determinare la tipologia di legami chimici che si instaura tra due specie chimiche:
- Quando due non metalli, aventi differenza di elettronegatività compresa tra 0 e 0,4 si legano tra loro, formano un legame covalente omopolare o apolare.
- Quando due non metalli, aventi differenza di elettronegatività compresa tra 0,4 e 1,9 si legano tra loro, formano un legame covalente eteropolare o polare.
- Quando due specie chimiche, aventi differenza di elettronegatività maggiore di 1,9 si legano tra loro, formano un legame ionico.
CONCETTI CHIAVE:
- L’elettronegatività esprime la tendenza di una specie chimica ad attrarre verso di sé la nuvola elettronica in un legame chimico.
- Fatta eccezione per i gas nobili, l’elettronegatività aumenta dal basso all’alto in un gruppo, e da sinistra a destra in un periodo.
- La differenza di elettronegatività può essere utilizzata per prevedere il tipo di legame tra due specie chimiche.
ESERCIZIO SVOLTO:
Ordinare i seguenti elementi per elettronegatività crescente, tenendo conto solo della loro posizione nella tavola periodica:
S, F, As, Sn, Ba
Ordinare gli elementi per elettronegatività crescente, significa partire dall’elemento con minore elettronegatività e via via arrivare a quello avente maggiore elettronegatività.
Nella tavola periodica, l’elettronegatività cresce dal basso all’alto in un gruppo, e da sinistra a destra in un periodo.
Pertanto l’ordine risulta essere il seguente:
Ba < Sn < As < S < F
