L’energia libera di Gibbs è una grandezza fisica utilizzata per determinare la spontaneità di una reazione chimica. Questa grandezza può essere impiegata anche per valutare la massima quantità di lavoro ottenibile da una trasformazione condotta in condizioni di temperatura e pressione costanti.
L’energia libera di Gibbs (G) è correlata all’entalpia, all’entropia di reazione e alla temperatura assoluta secondo la formula:
G = H – TS
G = energia libera di Gibbs espressa in J/mol
H = entalpia espressa in J/mol
T = temperatura assoluta espressa in gradi Kelvin
S = entropia espressa in J/(K·mol)
REAZIONI SPONTANEE
Per valutare la spontaneità di una reazione, a una determinata pressione e temperatura, si può calcolare la variazione di energia libera di Gibbs:
ΔG (P,T) = Gprodotti – Greagenti
Per una reazione:
aA + bB ⇄ rR + sS
ΔG = rGR + sGS – aGA – bGB
Se:
ΔG < 0 la reazione avviene spontaneamente.
ΔG = 0 la reazione è all’equilibrio.
ΔG > 0 la reazione diretta non è spontanea. Risulta invece spontanea la reazione inversa.

EQUAZIONE DI GIBBS-HELMHOLTZ
L’equazione di Gibbs-Helmholtz correla la variazione di energia libera di Gibbs di una reazione alla variazione di entalpia e alla variazione di entropia.
ΔG = ΔH – TΔS
ΔG (Gprodotti – Greagenti) = variazione di energia libera di Gibbs espressa in J/mol
ΔH (Hprodotti – Hreagenti) = variazione di entalpia espressa in J/mol
ΔS (Sprodotti – Sreagenti) = variazione di entropia espressa in J/(K·mol)
T = temperatura assoluta espressa in gradi Kelvin
Si possono verificare le seguenti condizioni:
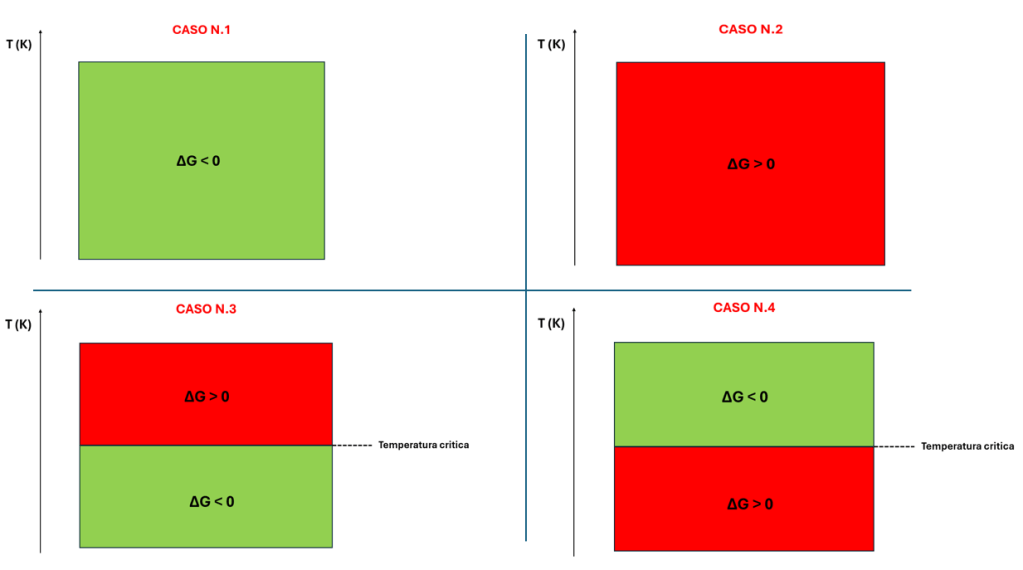
Caso n.1
ΔH<0 e ΔS>0 (reazione esotermica e variazione positiva di entropia).
ΔG<0 a qualsiasi valore di temperatura. La reazione è pertanto sempre spontanea.
Caso n.2
ΔH>0 e ΔS<0 (reazione endotermica e variazione negativa di entropia).
ΔG<0 a nessun valore di temperatura. La reazione non è pertanto mai spontanea. Risulta invece sempre spontanea la reazione inversa.
Caso n.3
ΔH<0 e ΔS<0 (reazione esotermica e variazione negativa di entropia).
ΔG<0 a valori di temperatura al di sotto di un determinato valore critico.
Caso n.4
ΔH>0 e ΔS>0 (reazione endotermica e variazione positiva di entropia).
ΔG<0 a valori di temperatura al di sopra di un determinato valore critico.
CONCETTI CHIAVE:
- L’energia libera di Gibbs è una grandezza impiegata per determinare la spontaneità di una reazione.
- Una reazione è spontanea se la variazione di energia libera di Gibbs è negativa.
- Quando la variazione dell’energia libera di Gibbs è nulla allora la reazione ha raggiunto l’equilibrio.
- L’energia libera di Gibbs è correlata all’entalpia e all’entropia di reazione mediante l’equazione di Gibbs-Helmholtz.
