La titolazione di un acido debole con una base forte prevede che vi sia una reazione chimica tra l’acido debole e la base forte.
- L’acido debole è l’analita, ovvero la sostanza che deve essere titolata.
- La base forte è il titolante, ovvero la sostanza che viene aggiunta all’analita.
Nella curva di titolazione viene graficato il valore del pH al variare del volume di titolante aggiunto.
La titolazione avviene fino al raggiungimento del punto equivalente, in cui la quantità di equivalenti di base eguaglia la quantità di equivalenti di acido.
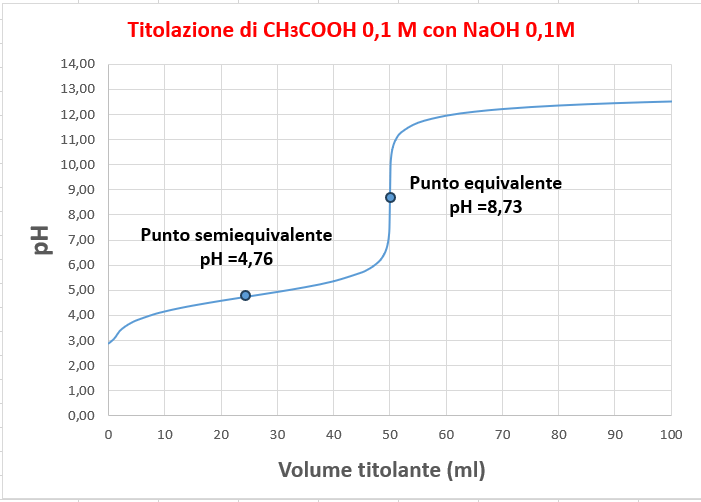
Per la titolazione di un acido debole con una base forte, esistono due punti caratteristici che sono:
- Il punto di semiequivalenza in cui il pH è uguale alla pKa dell’acido debole.
- Il punto equivalente in cui il pH risulta basico.
Titolazione di CH3COOH con NaOH
Si considerino 50 ml di una soluzione 0,1 M di CH3COOH (Ka = 1,75 · 10-5 e pKa = 4,76) che vengono titolati con una soluzione 0,1 M di NaOH. La reazione può essere descritta come:
CH3COOH + OH– → CH3COO– + H2O
Essendo CH3COOH una acido debole, il pH iniziale può essere calcolato tramite la formula semplificata:
PRIMA DEL PUNTO EQUIVALENTE
La reazione tra CH3COOH e NaOH porta alla formazione di una soluzione tampone in cui CH3COO– rappresenta la base coniugata dell’acido acetico.
Prima del raggiungimento del punto equivalente, è l’acido acetico a essere in eccesso, mentre l’idrossido di sodio è il reagente limitante.
Il pH può essere determinato tramite l’equazione di Henderson-Hasselbach.
PUNTO SEMIEQUIVALENTE
Una volta addizionate un numero di moli di NaOH pari alla metà del numero di moli di CH3COOH, risulta che:
[CH3COOH] = [CH3COO–]
Metà del numero di moli di CH3COOH sono state convertite in CH3COO–.
Il valore di pH coincide con il valore di pKa. Questo rappresenta il punto semiequivalente.
PUNTO EQUIVALENTE
Al raggiungimento del punto equivalente, tutte le moli di CH3COOH sono state convertite in CH3COO–. Le uniche specie presenti sono CH3COO– e H2O.
Lo ione CH3COO– dà reazione di idrolisi salina basica:
CH3COO– + H2O ⇄ CH3COOH + OH–
La formula per esprimere il pH è la seguente:
Da questo è possibile concludere che nella titolazione di un acido debole con una base forte, il pH al punto equivalente è basico.
DOPO IL PUNTO EQUIVALENTE
Aggiungendo un ulteriore quantità di base forte, il pH si sposta verso valori più basici. Essendo questa volta la base in eccesso e l’acido il reagente limitante, la concentrazione di ioni OH– può essere calcolata come:
pH = 14 – (-log10[OH–])
CURVA DI TITOLAZIONE