I2 + S + H2O → HI + H2SO4
Step 1 – Assegnare i numeri di ossidazione a tutti gli elementi presenti nella reazione:
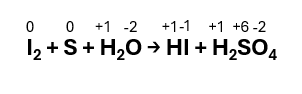
Step 2 – Individuare la specie che si ossida e che si riduce:
S si ossida passando da stato d’ossidazione 0 a +6 cedendo 6 elettroni;
I si riduce passando da stato d’ossidazione 0 a -1 acquistando 1 elettrone.
Step 3 – Scrivere le semi-reazioni di ossidazione e riduzione considerando solo gli elementi che acquistano e perdono elettroni.
S → S6++ 6e– (semi-reazione di ossidazione)
2I0 + 2e– → 2I– (semi-reazione di riduzione)
Questa reazione è stata scritta con il 2 come coefficiente stechiometrico in quanto in I2 sono presenti due atomi di Iodio).
Step 4 – Applicare la regola del prodotto incrociato e sommare in seguito le due reazioni:
S → S6++ 6e– ) x1
2I0 + 2e– → 2I– ) x3
S + 6I0+ 6e– → S6+ + 6I–+ 6e–
Si procede ad elidere gli elettroni:
S + 6I0 → S6+ + 6I–
Step 5 – Ricomporre la reazione tenendo conto dei nuovi coefficienti stechiometrici:
3I2 + S + H2O → 6HI + H2SO4
Step 6 – Si controlla che anche le altre specie non partecipanti alla reazione redox siano bilanciate, e in caso di problemi con Idrogeno e Ossigeno, si possono aggiungere anche molecole di acqua.
3I2 + S + 4H2O → 6HI + H2SO4

Un pensiero riguardo “ESERCIZIO 3 – REDOX IN FORMA MOLECOLARE”