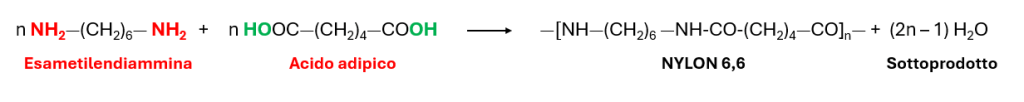Cu2+ + Fe → Cu+ + Fe2+
La specie che si ossida è il Ferro che passa da stato d’ossidazione 0 a +2 con la perdita di 2 elettroni.
La specie che si riduce è il Rame che passa da stato d’ossidazione +2 a +1 acquistando 1 elettrone.
Applichiamo il metodo delle semi-reazioni:
Semi-reazione di ossidazione:
Fe → Fe2+ + 2e–
Semi-reazione di riduzione:
Cu2+ + e– → Cu+
Entrambe le semi-reazioni sono bilanciate sia da un punto di vista di massa che di carica:
Nella semi-reazione di ossidazione si ha:
- Bilanciamento di massa – 1 Ferro a sinistra e 1 Ferro a destra.
- Bilanciamento di carica – Carica netta 0 a sinistra e carica netta 0 a destra (+2 del Fe2+ e -2 dei due elettroni).
Nella semi-reazione di riduzione si ha:
- Bilanciamento di massa – 1 Rame a sinistra e 1 Rame a destra.
- Bilanciamento di carica – Carica netta +1 a sinistra (+2 del Cu2+ e -1 dell’elettrone) e carica netta +1 a destra.
Per bilanciare la reazione, occorre applicare la regola del prodotto incrociato e poi sommare le due semi-reazioni.
Si moltiplica la semi-reazione di ossidazione per il numero di elettroni scambiati nella semi-reazione di riduzione e si moltiplica la semi-reazione di riduzione per il numero di elettroni scambiati nella semi-reazione di ossidazione.
Fe → Fe2+ + 2e– ) x1
Cu2+ + e– → Cu+ ) x2
Somma:
Fe + 2Cu2+ + 2e– → Fe2+ + 2Cu+ + 2e–
Infine, come in una normale equazione, si elidono gli elettroni.
Fe + 2Cu2+ → Fe2+ + 2Cu+
Si verifica infine che la reazione sia correttamente bilanciata:
Massa: 1 Ferro e 2 Rame a sinistra e 1 Ferro e 2 Rame a destra
Carica: +4 a sinistra e + 4 a destra.