La legge di Henry governa gli equilibri liquido-gas. Secondo tale legge, a una data temperatura, un gas si scioglie in un liquido fino a che la pressione esercitata sulla superficie del liquido uguaglia la pressione che il gas esercita al suo interno.
In un sistema chiuso, raggiunta la condizione di equilibrio, il numero di molecole di gas che nell’unità di tempo passano dalla fase liquida alla fase gassosa uguaglia il numero di molecole che dalla fase gassosa passa alla fase liquida.
All’aumentare della pressione si ha una maggiore solubilità del gas nel liquido. L’equilibrio è pertanto caratterizzato da una maggiore quantità di gas disciolta nel liquido.
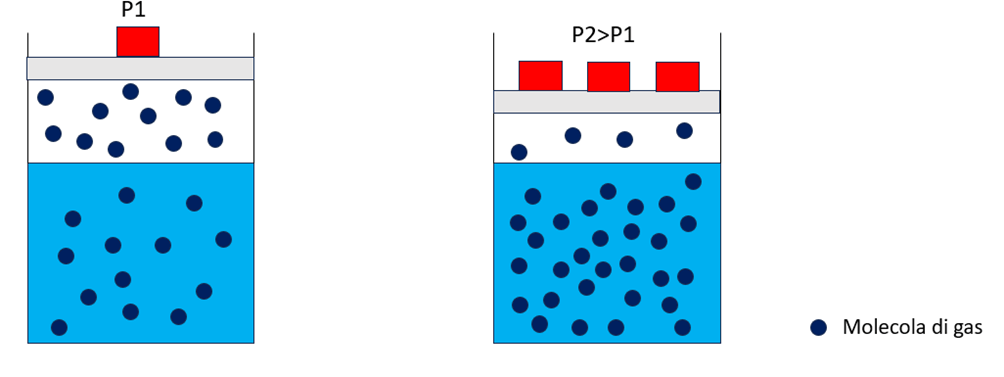
Figura 1 – Dipendenza della solubilità del gas nel liquido al variare della pressione
Anche la temperatura gioca un ruolo chiave nel regolare la solubilità di un gas in un liquido. A una data pressione, la solubilità di un gas in un liquido diminuisce all’aumentare della temperatura.
FORMULE PER ESPRIMERE LA LEGGE DI HENRY
Esistono diverse equazioni per esprimere la legge di Henry:
C = kP
In questa espressione, P rappresenta la pressione che il gas esercita sulla superficie del liquido, C la concentrazione del gas nel liquido mentre k è una costante chiamata costante di Henry il cui valore è correlato alla natura del gas, del liquido e dalla temperatura.
Dall’analisi dimensionale si evidenzia come l’unità di misura di questa costante sia pari a mol/(Latm).
P = kx
In questa espressione, P rappresenta la pressione che il gas esercita sulla superficie del liquido, x la frazione molare del gas nel liquido mentre k è la costante di Henry il cui valore è correlato alla natura del gas, del liquido e dalla temperatura.
Dall’analisi dimensionale si evidenzia come l’unità di misura di questa costante sia pari a una pressione (atm).
yPtot = kx
In questa espressione compare la legge di Dalton delle pressioni parziali. Può essere utilizzata quando in fase aeriforme è presente una miscela di gas.
y rappresenta la frazione molare del gas in fase gassosa, Ptot rappresenta la pressione totale che l’intera miscela di gas esercita sulla superficie del liquido, x la frazione molare del gas nel liquido e k è la costante di Henry il cui valore è correlato alla natura del gas, del liquido e dalla temperatura.
Dall’analisi dimensionale si evidenzia come l’unità di misura di questa costante sia anche in questo caso pari a una pressione (atm).
CONCETTI CHIAVE:
- La legge di Henry governa gli equilibri liquidi-gas.
- Diminuire la pressione e aumentare la temperatura rendono sfavorevole la solubilizzazione di un gas in un liquido.
- Aumentare la pressione e diminuire la temperatura rendono favorevole la solubilizzazione di un gas in un liquido.
