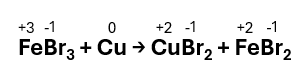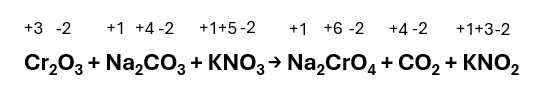Mg + KNO3 → Mg(NO3)2 + K
Step 1 – Assegnare i numeri di ossidazione a tutti gli elementi presenti nella reazione:
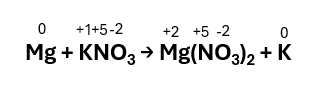
Step 2 – Individuare la specie che si ossida e che si riduce:
Mg si ossida passando da stato d’ossidazione 0 a +2 cedendo 2 elettroni;
K si riduce passando da stato d’ossidazione +1 a 0 acquistando 1 elettrone.
Step 3 – Scrivere le semi-reazioni di ossidazione e riduzione considerando solo gli elementi che acquistano e perdono elettroni.
Mg → Mg2++ 2e– (semi-reazione di ossidazione)
K+ + e– → K (semi-reazione di riduzione)
Step 4 – Applicare la regola del prodotto incrociato e sommare in seguito le due reazioni:
Mg → Mg2++ 2e– ) x1
K+ + e– → K ) x2
Mg + 2K++ 2e– → Mg2+ + 2K + 2e–
Si procede ad elidere gli elettroni:
Mg + 2K+ → Mg2+ + 2K
Step 5 – Ricomporre la reazione tenendo conto dei nuovi coefficienti stechiometrici:
Mg + 2KNO3 → Mg(NO3)2 + 2K
Step 6 – Si controlla che anche le altre specie non partecipanti alla reazione redox siano bilanciate, e in caso di problemi con Idrogeno e Ossigeno, si possono aggiungere anche molecole di acqua.
Mg + 2KNO3 → Mg(NO3)2 + 2K