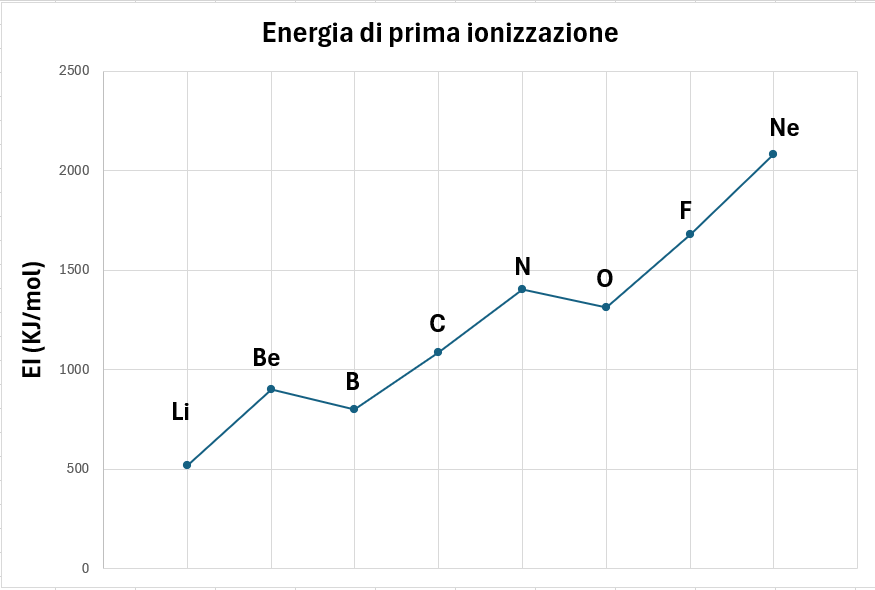
Un elettrone che si trova in un livello n risente dell’attrazione esercitata dal nucleo dell’atomo carico positivamente.
Questa forza di attrazione è tanto più attenuata quanto maggiore è l’effetto di schermo esercitato dagli elettroni dei livelli più interni chiamati anche elettroni di core. La carica nucleare “reale” di cui risente un elettrone prende il nome di carica nucleare efficace.
La carica nucleare efficace Z* può essere calcolata come:
Z* = Z – S
Z* = carica nucleare efficace
Z = numero atomico dell’elemento
S = effetto di schermo
REGOLE DI SLATER
Per calcolale l’effetto di schermo si possono utilizzare le regole di Slater.
Per prima cosa occorre scrivere la configurazione elettronica dell’elemento riportando gli orbitali all’interno di orbitali in questo ordine di raggruppamento:
(1s),(2s,2p),(3s,3p),(3d),(4s,4p),(4d),(4f),(5s,5p) ecc.
Occorre successivamente applicare le seguenti regole per il calcolo di S:
- Elettroni che appartengono a gruppi superiori rispetto a quello occupato dall’elettrone in esame non danno alcun contributo allo schermaggio;
- ogni altro elettrone del gruppo (ns,np) dà un contributo di valore 0,35 allo schermaggio, tranne per il gruppo (1s) che contribuisce per un valore pari a 0,30;
- ogni elettrone del guscio (n − 1) dà un contributo di schermaggio uguale a 0,85;
- ogni elettrone appartenente al guscio (n − 2) o inferiori dà un contributo di schermaggio pari a 1,00;
Se l’elettrone in esame è in un orbitale nd o nf, valgono le presenti considerazioni:
- gli altri elettroni del gruppo (nd) o (nf) danno contributo pari a 0,35;
- gli elettroni di tutti i gruppi sottostanti danno un di schermaggio pari a 1,00.
ESERCIZIO SVOLTO N.1
Calcolare la calcolare nucleare efficace Z* sperimentate da un elettrone di valenza dell’elemento fosforo.
Il fosforo P è il quindicesimo elemento della tavola periodica e pertanto ha numero atomico Z=15.
La sua configurazione elettronica può essere scritta come (1s2)(2s22p6)(3s23p3).
- 5 elettroni sono di valenza
- 10 elettroni di core
Un elettrone di valenza risente dell’effetto schermante esercitato da
4 elettroni del suo stesso livello,
8 elettroni del livello n-1,
2 elettroni del livello n-2.
S = 4 · 0,35 + 8 · 0,85 + 2 · 1,00 = 10,20
Pertanto:
Z* = 15 – 10,20 = 4,80
ESERCIZIO SVOLTO N.2
Calcolare la calcolare nucleare efficace Z* sperimentate da un elettrone nell’orbitale 3d dell’elemento zinco.
Lo zinco Zn è il trentesimo elemento della tavola periodica e pertanto ha numero atomico Z=30.
La sua configurazione elettronica può essere scritta come (1s2)(2s22p6)(3s23p6)(3d10)(4s2).
Gli elettroni del gruppo 4s non danno alcun contributo all’effetto schermante.
Un elettrone del gruppo 3d risente dell’effetto schermante esercitato da:
9 elettroni del suo stesso gruppo,
18 elettroni dei livelli inferiori
S = 9 · 0,35 + 18 · 1,00 = 21,15
Pertanto:
Z* = 30 – 21,15 = 8,85