I metalli hanno un’elevata conduttività elettrica e termica dovuta all’elevata mobilità dei suoi elettroni di valenza.
Il legame metallico coinvolge un elevato numero di atomi metallici che formano una struttura cristallina in cui le cariche positive sono circondate da una nube o un mare di elettroni (Figura 1).

Figura 1 – Rappresentazione schematica di una struttura metallica con le cariche positive circondate da una nube elettronica
Le cariche positive sono gli atomi metallici a cui sono stati sottratti gli elettroni di valenza i quali vanno a costituire la nube di elettroni.
Una delle proprietà dei metalli è quella di possedere un’alta densità e un’elevata temperatura di fusione in virtù della capacità di questa nube elettronica di tenere strettamente coese queste cariche positive.
Un’altra proprietà caratteristica è la malleabilità e la duttilità che rappresentano la capacità di essere ridotti rispettivamente in fogli e fili sottili. Inoltre, un metallo può essere tirato senza che vada incontro a frattura.
Lo scorrimento di un piano rispetto a un altro porterebbe le cariche positive a entrare in contatto l’una con l’altra e con questo si creerebbero forze repulsive capaci di disfare l’intera struttura cristallina. Tutto ciò viene evitato dalla nube elettronica che si frappone tra le cariche esercitando un effetto cuscinetto (Figura 2).
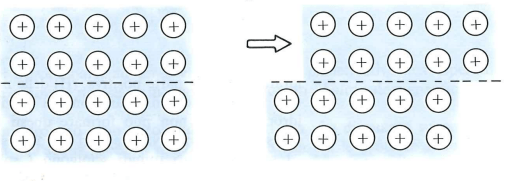
Figura 2 – Scorrimento di un piano cristallino in cui si evidenzia l’effetto tampone esercitato dalla nube elettronica che si frappone tra le cariche positive.
CONCETTI CHIAVE:
- Il legame metallico coinvolge un elevato numero di atomi che vanno nel loro insieme a costituire un reticolo cristallino.
- La bassa energia di ionizzazione posseduta dei metalli porta alla formazione di una struttura in cui vi sono cariche positive circondate da una nube di elettroni.
- I metalli possono essere tirati senza fratturarsi in virtù dell’effetto cuscinetto esercitato dalla nube elettronica che si frappone tra le cariche positive.
