Secondo la legge di Boyle, il volume occupato da un gas ideale, in condizioni isoterme (temperatura costante), è inversamente proporzionale alla pressione a cui il gas è soggetto.
PV = k
- P è la pressione.
- V è il volume.
- k è una costante.
S’immagini di avere delle molecole di gas all’interno di un contenitore a pareti rigide. Da un punto di vista microscopico, la pressione all’interno del contenitore è legata al numero di urti che le molecole esercitano contro le pareti del contenitore. Riducendo il volume del contenitore si assiste a un avvicinamento reciproco delle molecole e al conseguente incremento del numero di urti contro le pareti (Figura 1).

Figura 1 – Effetto di una riduzione del volume sul numero di urti per un gas ideale
Il grafico presente in Figura 2 mostra come per ottenere un raddoppio della pressione occorra un dimezzamento del volume, a un incremento triplo della pressione corrisponda una riduzione di tre volte il volume iniziale e così via.
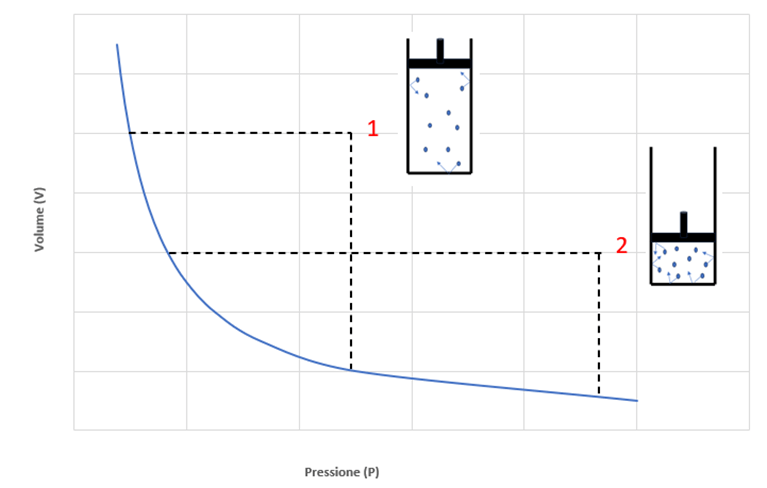
Figura 2 – Volume di un gas ideale in funzione della sua pressione
A temperatura costante il volume di un gas è direttamente proporzionale al reciproco della pressione applicata (Figura 3).

Figura 3 – Volume di un gas ideale in funzione del reciproco della pressione.
(a temperatura e n° di moli di gas costanti)
PV = k
Per mantenere costante questo prodotto, è necessario che al raddoppiare di uno vi sia il dimezzamento dell’altro. Questa legge, che prende il nome di Legge di Boyle o legge pressione-volume, vale per tutti i tipi di gas il cui comportamento venga assunto come ideale.
CONCETTI CHIAVE:
- La legge di Boyle afferma che il volume occupato da un gas è inversamente proporzione alla pressione a cui è sottoposto in condizioni isoterme.
- La legge di Boyle si applica a tutti i tipi di gas il cui comportamento venga assunto come ideale.
- La legge di Boyle rappresenta uno dei capisaldi per la formulazione dell’equazione di stato dei gas ideali o perfetti.
