Il numero quantico principale n
Come visto nel capitolo sulla struttura atomica, un atomo è costituita da un nucleo interno con protoni e neutroni mentre gli elettroni sono collocati esternamente. Quest’ultimi possono ruotare attorno al nucleo lungo specifiche orbite chiamate livelli o strati (Figura 1).
Figura 1 – Rappresentazione semplificata della struttura atomica con le orbite degli elettroni collocate fuori dal nucleo
Man mano che ci si allontana verso gli strati più esterni, l’effetto di attrazione esercitato dal nucleo carico positivamente diminuisce. Ogni livello può essere rappresentato da un numero n chiamato numero quantico principale che assume valore interi a partire da 1. Più raramente i livelli vengono rappresentati con delle lettere maiuscole. Per n=1 si avrà la lettera K, per n=2 la lettera L, per n=3 la lettera M, per n=4 la lettera N e così via.
Il numero massimo di elettroni che possono essere presenti in un livello n è uguale a 2n2 (Figura 2).

Figura 2 – Massimo numero di elettroni per ogni livello energetico.
Il numero quantico secondario l
A ogni livello n sono associati dei sottolivelli energetici. In particolare, è stato osservato che per n=1 esiste solo un sottolivello, per n=2 ne esistono due, per n=3 tre e così via. Ogni sottolivello può essere denominato con delle lettere che sono s, p, d, f.

Figura 3 – Rappresentazione dei sottolivelli energetici associati a ogni livello energetico n
Ogni sottolivello è definito attraverso un numero quantico secondario l che può assumere valori interi che vanno da 0 fino ad n-1. A uno specifico valore di l è sempre associato un determinato sottolivello:
- Per l=0 si ha il sottolivello s
- Per l=1 si ha il sottolivello p
- Per l=2 si ha il sottolivello d
- Per l=3 si ha il sottolivello f
| Numero quantico principale n | Numero quantico secondario l | Numero di sottolivelli energetici | Nome dei sottolivelli energetici |
| 1 | 0 | 1 | s |
| 2 | 0;1 | 2 | s;p |
| 3 | 0;1;2 | 3 | s;p;d |
| 4 | 0;1;2;3 | 4 | s;p;d;f |
Ogni sottolivello energetico rappresenta un gruppo di orbitali. Nel primo livello elettronico (n=1) è presente un solo gruppo di orbitali, chiamati orbitali s. Nel secondo livello esistono due gruppi di orbitali (s, p) nel terzo tre (s, p, d) e nel quarto quattro (s, p, d, f). Attenzione, un gruppo di orbitali non significa necessariamente un orbitale!
Il numero quantico magnetico m
A ogni sottolivello energetico corrisponde un certo numero di orbitali, ovvero delle regioni di spazio in cui è alta la probabilità di trovare un elettrone. Questo livello di probabilità viene stimata essere superiore al 90%.
Per descrivere questi orbitali si fa ricorso al numero quantico m detto anche numero quantico magnetico. Questo numero può assumere valori interi che vanno da –l fino +l passando per lo zero. A un dato valore di l, possono essere associati uno o più valori di m. I valori che assume il numero quantico m esprimono il numero di orbitali atomici associati a uno specifico gruppo di orbitali, ovvero a un numero quantico secondario l.
Per n=1 si ha l=0 e m=0. Al numero quantico magnetico m è permesso un solo valore m=0. Questo indica che al sottolivello energetico l=0 (sottolivello s) è associato un solo orbitale atomico. Tale orbitale atomico prende il nome di orbitale 1s il cui nome è ottenuto associando al valore del numero quantico principale n il nome del sottolivello energetico.
Per n=2 si hanno due possibili casi:
n=2; l=0; m=0. Questo è un caso analogo a quello appena visto in cui al numero quantico m è associato un solo valore. Si ha in questo caso un singolo orbitale atomico che prende il nome di orbitale 2s.
n=2; l=1; m=-1;0;+1. In questa situazione il numero quantico magnetico m assume tre valori. Al sottolivello energetico l=1 (sottolivello p) sono associati tre orbitali atomici degeneri (aventi stessa energia). Tali orbitali atomici prendono il nome di orbitali 2p.
In Tabella 2 sono riassunte tutte le relazioni tra il numero quantico principale n, il numero quantico secondario l, il numero quantico magnetico m e gli orbitali atomici.
| Valori di n | Valori di l | Sottolivello | Valori di m | Orbitali atomici |
| 1 | 0 | s | 0 | Un orbitale 1s |
| 2 | 0 | s | 0 | Un orbitale 2s |
| 1 | p | -1;0;+1 | Tre orbitali 2p | |
| 3 | 0 | s | 0 | Un orbitale 3s |
| 1 | p | -1;0;+1 | Tre orbitali 3p | |
| 2 | d | -2;-1;0;+1;+2 | Cinque orbitali 3d | |
| 4 | 0 | s | 0 | Un orbitale 4s |
| 1 | p | -1;0;+1 | Tre orbitali 4p | |
| 2 | d | -2;-1;0;+1;+2 | Cinque orbitali 4d | |
| 3 | f | -3;-2;-1;0;+1;+2;+3 | Sette orbitali 4f |
Dai dati raccolti in Tabella 2, è possibile trarre le seguenti conclusioni:
a) Al sottolivello s è associato un orbitale (l=0 e m=0)
b) Al sottolivello p sono associati tre orbitali degeneri (l=1 e m= -1;0;+1)
c) Al sottolivello d sono associati cinque orbitali degeneri (l=2 e m=-2;-1;0;+1;+2)
d) Al sottolivello f sono associati sette orbitali degeneri (l=3 e m= -3;-2;-1;0;+1;+2;+3)
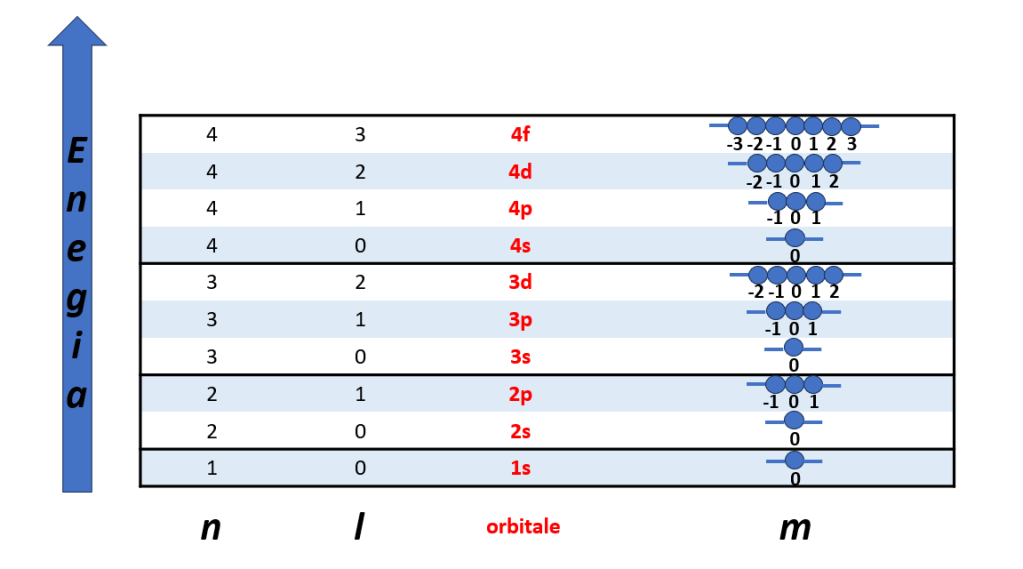
Figura 4 – Numero quantico magnetico m associato ai singoli orbitali atomici
Il Numero quantico di spin s
Esiste infine un quarto numero quantico detto numero quantico di spin s che può assumere valore di +1/2 o -1/2. Per descrivere tale grandezza si può immaginare l’elettrone come ruotante attorno al proprio asse analogamente a quanto fa la Terra nella rotazione attorno al Sole.
Tale rotazione può essere compiuta in senso orario o antiorario. A seconda della direzione il valore di numero quantico di spin s è uguale a +1/2 o -1/2.
Ogni elettrone può essere descritto attraverso i quattro numeri quantici n, l, m, s. Un elettrone all’interno dell’orbitale 2s è descritto da n=2; l=0; m=0 e s=+1/2 (si assuma che l’elettrone ruoti in senso orario attorno al proprio asse).
Il principio di esclusione di Pauli stabilisce che in un atomo non esistono due elettroni aventi gli stessi valori dei quattro numeri quantici. Pertanto, s’immagini di avere due elettroni all’interno dell’orbitale 2s uno ruotante in senso orario mentre l’altro in senso antiorario. Il primo può essere descritto come n=2; l=0; m=0; s=+1/2 mentre il secondo come n=2; l=0; m=0; s=-1/2. Dal momento che i numeri quantici di spin s non è possibile inserire all’interno dell’orbitale 2s un terzo elettrone, in quanto questo dovrebbe assumere gli stessi valori dei quattro numeri quantici di uno dei due elettroni già presenti.
Da questo è possibile concludere che in un orbitale atomico possono essere presenti al massimo due elettroni. Questi due elettroni, all’interno del medesimo orbitale, devono avere spin opposto.
Concetti chiave:
1) Il primo livello (n=1) è formato da un sottolivello (l=0) contenente un solo orbitale 1s.
2) Il secondo livello (n=2) è formato da due sottolivelli (s e p): il primo sottolivello contiene un orbitale 2s, il secondo sottolivello contiene tre orbitali 2p.
3) Il terzo livello (n=3) è formato da tre sottolivelli: il primo sottolivello contiene un orbitale 3s, il secondo sottolivello contiene tre orbitali 3p, il terzo sottolivello contiene cinque orbitali 3d.
4) Il quarto livello (n=4) è formato da quattro sottolivelli: il primo sottolivello contiene un orbitale 4s, il secondo sottolivello contiene tre orbitali 4p, il terzo sottolivello contiene cinque orbitali 4d, il quarto sottolivello contenente sette orbitali 4f.
Figura 5 – Immagine riassuntiva sulla rappresentazione degli orbitali atomici
- Nel primo livello n=1 è presente un solo orbitale. Il principio di esclusione di Pauli prevede che possano essere presenti al massimo 2 elettroni.
- Nel secondo livello n=2 sono presenti quattro orbitali. Il principio di esclusione di Pauli prevede che possano essere presenti al massimo 8 elettroni.
- Nel terzo livello n=3 sono presenti nove orbitali. Il principio di esclusione di Pauli prevede che possano essere presenti al massimo 18 elettroni.
- Nel quarto livello n=4 sono presenti sedici orbitali. Il principio di esclusione di Pauli prevede che possano essere presenti al massimo 32 elettroni.


