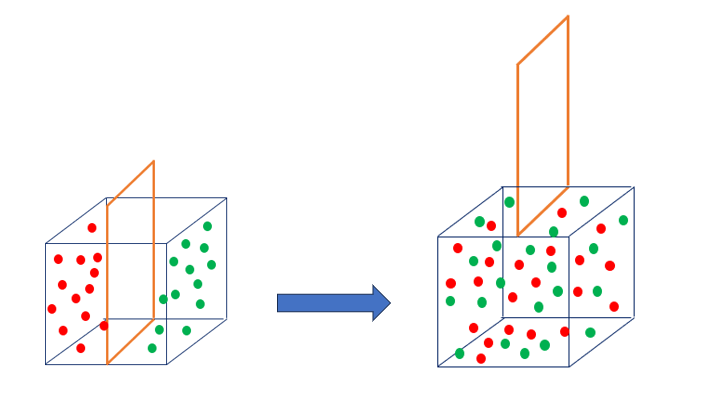
Una soluzione si compone di un solvente e di un soluto. Il soluto è il componente presente in minore quantità mentre il solvente quello presente in misura prevalente.
La quantità di soluto presente in una certa quantità di solvente descrive la concentrazione della soluzione.
Per esprimere la concentrazione di una soluzione esistono diverse grandezze fisiche:
- Molarità o Concentrazione Molare.
- Percentuale in massa.
- Percentuale in volume.
- Percentuale massa su volume.
- Molalità o Concentrazione Molale.
- Frazione molare.
- Normalità.
Molarità o Concentrazione Molare (M)
La molarità o concentrazione molare esprime il numero di moli di soluto nel volume di soluzione.
L’unità di misura è mol/L.
Percentuale in massa (% m/m)
La percentuale in massa esprime il rapporto tra la massa di soluto e la massa di soluzione.
Il risultato è un numero percentuale.
Percentuale in volume (% V/V)
La percentuale in volume esprime il rapporto tra il volume di soluto rispetto al volume di soluzione.
Il risultato è un numero percentuale.
Percentuale massa su volume (% m/V)
La percentuale massa su volume è una grandezza che quantifica la massa di soluto presente in un volume di soluzione.
Il risultato è un numero percentuale.
Molalità o Concentrazione Molale (m)
La molalità o concentrazione molale esprime il numero di moli di soluto rispetto alla massa di solvente puro.
L’unità di misura è mol/Kg.
Frazione molare
In una soluzione costituita da due componenti “a” e “b” la frazione molare del componente “a” si esprime con il rapporto tra il numero di moli di “a” rispetto alla somma delle moli di tutti componenti.
La frazione molare è un numero adimensionale compreso tra 0 e 1. La somma delle frazioni molari di tutti i componenti presenti in soluzione è sempre uguale a 1.
Moltiplicando per 100 la frazione molare del componente “a” si ottiene la percentuale molare.
Normalità
La normalità esprime il numero di equivalenti di soluto rispetto al volume di soluzione.
L’unità di misura è eq/L.
Esercizio svolto
Determinare la molarità e la percentuale massa su volume di una soluzione ottenuta sciogliendo 5 g esatti di NaCl in 2 litri d’acqua. Si assuma che l’aggiunta di sale non provochi alcun aumento di volume.
Per calcolare la molarità occorre determinare il numero di moli presenti in 5 grammi di NaCl.
Il sodio (Na) ha una massa molare pari a 22,99 g/mol, mentre il cloro (Cl) 35,45 g/mol.
A questo punto, conoscendo il volume della soluzione, è possibile ottenere la concentrazione molare:
Il calcolo della percentuale massa su volume prevede la conoscenza della quantità di soluto in unità di grammi e il volume di soluzione in unità di ml.