OF2
Il composto nel suo complesso è elettricamente neutro.
Nel caso di questo composto, l’Ossigeno (O) forma due legami con altrettanti atomi di Fluoro (F). Ciascun legame è costituito da due elettroni, uno messo in co-partecipazione dall’Ossigeno e l’altro dal Fluoro.
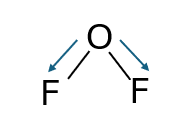
I due elettroni di legame dell’Ossigeno vengono ceduti ai due atomi di Fluoro. L’Ossigeno, cedendo due elettroni, acquisisce uno stato d’ossidazione di +2, mentre ciascun Fluoro, acquistando un elettrone dall’Ossigeno, assume una carica formale di -1.
Questo è uno dei rari casi in cui l’Ossigeno ha uno stato d’ossidazione diverso da -2.
Calcolo della carica complessiva: 1 x (+2) + 2 x (-1) = 0
Soluzione:
Numero d’ossidazione O = +2
Numero d’ossidazione F = -1
