Il raggio atomico di un elemento chimico esprime la dimensione degli atomi che lo costituiscono.
Dal momento che l’atomo è costituito da un nucleo centrale carico positivamente e da elettroni collocati esternamente, il raggio atomico è correlato alla distanza tra il nucleo stesso e i suoi elettroni più esterni.
RAGGIO ATOMICO E TAVOLA PERIODICA
Dalla tavola periodica è possibile individuare un andamento del raggio atomico (Figura 1) secondo cui, a parte qualche eccezione:
- Il raggio atomico cresce dall’alto al basso all’interno di un gruppo a causa della maggiore dimensione degli orbitali atomici che aumentano la distanza nucleo-elettrone.
- Il raggio atomico decresce da sinistra a destra lungo un periodo a causa dell’aumento della carica nucleare efficace.
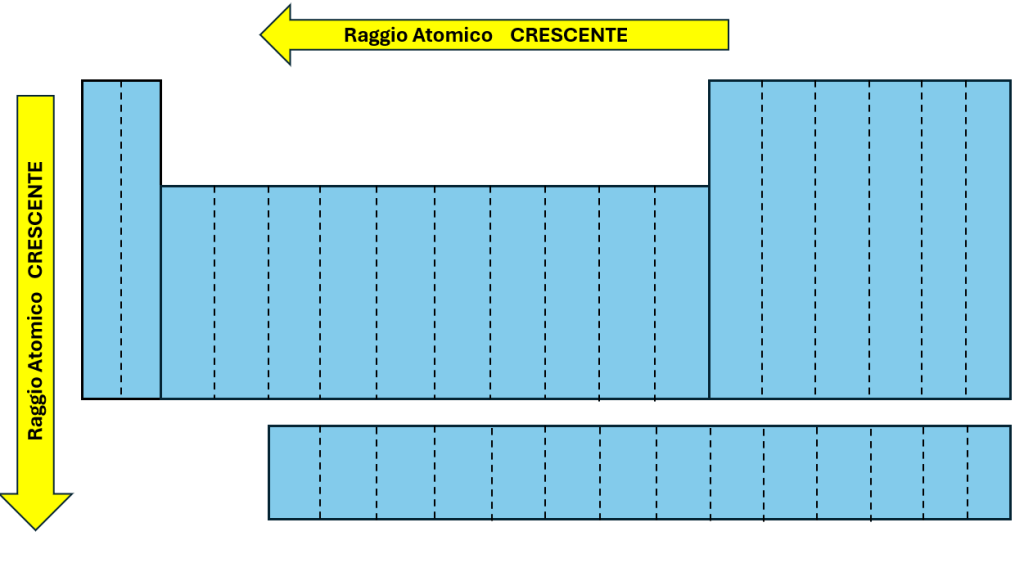
Figura 1 – Andamento del raggio atomico nella tavola periodica
CONCETTI CHIAVE:
- Il raggio atomico è una misura della dimensione degli atomi di un elemento chimico.
- Il raggio atomico cresce dall’alto al basso in un gruppo e da destra a sinistra in un periodo.
ESERCIZIO SVOLTO:
Ordinare i seguenti elementi per raggio atomico crescente, tenendo conto solo della loro posizione nella tavola periodica:
Mg, C, Cs, Be, N
Ordinare gli elementi per raggio atomico crescente, significa partire dall’elemento con minore raggio atomico e via via arrivare a quello avente maggiore raggio atomico.
Nella tavola periodica, il raggio atomico cresce dall’alto al basso in un gruppo, e da destra a sinistra in un periodo.
Pertanto l’ordine risulta essere il seguente
N < C < Be < Mg < Cs